Instructions d`utilisation

IFU / Instructions d’utilisation 1 / 9 Rév. 2015-06-12
Instructions d’utilisation
Lentilles intraoculaires acryliques multifocales diffractives hydrophiles stériles destinées à une
implantation dans le sac capsulaire
Ces instructions d’utilisation sont également disponibles au format électronique sur notre
site Internet. Veuillez consulter le site www.1stQ.eu.
Contenu :
Une lentille intraoculaire (IOL) apodisée diffractive souple stérile à usage unique composée d’un
acrylique hydrophile hautement purifié avec un absorbeur d’U.V. lié de façon covalente.
Certaines des lentilles acryliques sont fabriquées avec en option un agent chromophore jaune lié de
façon covalente pour filtrer la lumière bleue. Ces lentilles sont identifiables au « Y » figurant dans
leur code de produit.
Description :
Cette lentille intraoculaire est un produit optique extrêmement précis. Le système de fabrication et
de gestion de la qualité de 1stQ est conforme aux normes internationales et possède les
certifications ISO 13485 et 93/42/CE.
Souple, le matériau utilisé pour fabriquer la lentille peut être plié avant l’implantation de manière à
pouvoir effectuer cette dernière en pratiquant une incision de taille inférieure au diamètre optique
de la lentille. Une fois insérée chirurgicalement dans l’œil, la lentille se déploie délicatement pour
rétablir les performances visuelles.
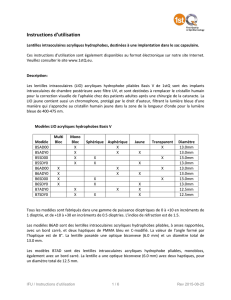
Les propriétés optiques et les dimensions de la lentille sont indiquées sur les étiquettes de ses
emballages primaire et secondaire.
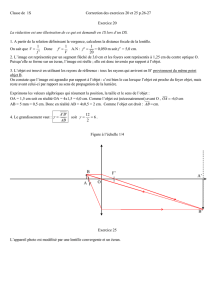
La partie diffractive apodisée de la lentille est située sur la surface antérieure de l’implant. La
tolérance de réfraction est de ± 0,25 dioptrie entre 0,0 et +30,0 dioptries, et de ± 0,50 dioptrie pour
les puissances supérieures à 30,0 dioptries. L’addition pour la vision de près est indiquée sur
l’étiquette.
Indications d’utilisation :
Sauf mention contraire sur la boîte pliante, tous les implants de base 1stQ peuvent être utilisés pour
une implantation dans le sac capsulaire de l’œil adulte après le retrait d’une lentille atteinte de
cataracte par extraction de cataracte extracapsulaire, y compris par phacoémulsification.
Cet implant multifocal offre la correction visuelle nécessaire dans les situations d’aphakie
postopératoires et pour tout défaut de réfraction chez un patient souhaitant bénéficier d’une
meilleure vision de près et de loin sans devoir recourir systématiquement au port de lunettes.
Contre-indications :
L’implantation d’une lentille intraoculaire diffractive multifocale est déconseillée aux patients
présentant les caractéristiques suivantes :
Les personnes qui, dans leur vie courante ou dans le cadre de leurs profession ou loisirs,
nécessitent une bonne vision de nuit

IFU / Instructions d’utilisation 2 / 9 Rév. 2015-06-12
Les personnes qui ont besoin de bénéficier d’une excellente vision de près dans des
conditions de pénombre
Les personnes qui pilotent des avions, que ce soit dans le cadre de leur profession ou de leurs
loisirs
Les personnes aimant porter des lunettes
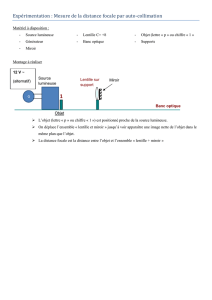
Conditionnement :
La lentille hydrophile hydratée est placée sur un porte-lentille fixé dans le bouchon à vis en plastique
d’un flacon de verre ou récipient en plastique contenant de l’eau stérile.
Le flacon/récipient est recouvert d’une poche stérile pelable ou d’un emballage-coque stérile.
L’emballage général contient la notice médicale, un jeu d’étiquettes autocollantes destinées à
identifier le produit à des fins administratives et une carte patient à compléter et à remettre au
patient.
Stérilisation :
Cette lentille intraoculaire a été stérilisée à la vapeur après avoir été emballée dans des conditions de
salle blanche.
La stérilité est garantie uniquement sous réserve que l’emballage ne soit ni ouvert ni endommagé. La
procédure de stérilisation utilisée figure sur la boîte pliante.
L’indicateur change de couleur pour passer du rose au marron au contact de la vapeur lors de la
stérilisation.
Transport, stockage et gestion des déchets :
Manipuler avec précaution
Conserver à température ambiante
Ne pas exposer à la lumière directe du soleil ou à des températures extrêmes
Ne pas congeler
Conserver dans un endroit sec, à l’abri de l’humidité et de l’eau
Ce produit et ses déchets doivent être éliminés conformément aux réglementations et exigences
locales et nationales.
Péremption :
N’utilisez pas ce dispositif médical une fois la date de péremption indiquée sur la boîte, la poche,
l’emballage-coque ou le récipient primaire atteinte. La date de péremption correspond au premier
jour du mois de péremption indiqué.
Mises en garde :
Ne pas utiliser si l’emballage est ouvert ou endommagé.
Ne pas restériliser de quelque manière que ce soit.
Ne pas utiliser après la date de péremption.
Ne pas réutiliser : même occasionnelle, toute réutilisation doit être évitée, car une telle
pratique présenterait des risques sanitaires importants en raison du manque de stérilité ou
d’éventuels défauts mécaniques liés à l’utilisation antérieure.
Utiliser uniquement des solutions de rinçage intraoculaires stériles comme la solution de
Ringer ou une solution stérile BSS.
Ne pas utiliser l’implant hydrophile si le récipient de la lentille est vide.

IFU / Instructions d’utilisation 3 / 9 Rév. 2015-06-12
En cas de stockage de l’implant hydrophile en dessous de la température ambiante avant
l’implantation, la lentille est susceptible de présenter une opacité temporaire. Il s’agit d’une
réaction physique qui n’endommage en aucun cas le matériau de fabrication de la lentille et
qui disparaît après le retour à des conditions normales dans chaque étui.
Précautions :
Une très grande dextérité chirurgicale est nécessaire pour réaliser une implantation correcte. Le
chirurgien intervenant doit avoir observé et/ou assisté à de nombreuses implantations de dispositifs
et avoir validé une ou plusieurs formations appropriées avant de tenter de réaliser une implantation.
Le chirurgien en charge de l’implantation doit lire tous les documents fournis par 1stQ avant de
réaliser l’implantation, de manière à garantir une manipulation et une mise en place correctes de cet
implant.
Le calcul précis de la puissance est un critère primordial pour la réussite de l’implantation.
Avant la procédure, le chirurgien doit se livrer à une minutieuse évaluation préopératoire ainsi qu’à
une évaluation clinique de manière à jauger les risques et avantages associés à l’implantation si le
patient présente un ou plusieurs des états préexistants suivants, tels que décrits dans la littérature
scientifique pertinente :
Patients possédant seulement un œil
Déficiences dans la perception des couleurs
Troubles de la coagulation
Décollement de la rétine, historique médical de rétinopathie prématurée
Traitement en cours ou récent aux anticoagulants, antiplaquettaires ou antagonistes
systémiques alpha-1a adrénergiques (p. ex., Tamsulosine)
Chirurgie ophtalmologique préalable, notamment : chirurgie kératoréfractive, kératoplastie
(pénétrante), pars plana vitrectomie, indentation sclérale
Diabète et ses complications, comme la rétinopathie diabétique proliférante
Variations anatomiques, telles qu’une difficulté d’accès à l’œil (enfoncement oculaire), une
microphthalmie, une chambre antérieure extrêmement plate ou un myosis pupillaire
Toute maladie oculaire grave : uvéite, glaucome, hypermétropie et myopie très prononcées,
syndrome pseudo-exfoliatif
Maladies de la cornée, comme la dystrophie endothéliale de Fuchs, sévère dystrophie de la
cornée, astigmatisme cornéen irrégulier
Maladies de l’iris telles que la synéchie, l’atrophie de l’iris ou la rubéose de l’iris
Fragilité ou déhiscence zonulaire et luxation capsulaire potentielle
Cataractes spécifiques : cataracte particulièrement dense, cataracte postérieure, blanche,
brune, cataracte issue de la rubéole et cataracte non liée à l’âge
Dysfonctionnement de la choroïde, de la rétine et du nerf optique, hémorragies
choroïdiennes, décollement de la rétine, dégénérescence maculaire et dystrophie sévère du
nerf optique
Utilisation de gaz de tamponnement rétinien intraoculaire :
Une détérioration de la transparence de la lentille intraoculaire implantée dans l’œil humain a été
constatée après l’administration intraoculaire de gaz SF6 ou C3F8, donnant parfois lieu à l’apparition
d’une brume visuellement handicapante susceptible de nécessiter un changement d’implant.

IFU / Instructions d’utilisation 4 / 9 Rév. 2015-06-12
Opacification capsulaire postérieure (OCP) :
L’OCP demeure l’une des complications postopératoires les plus courantes de l’opération de la
cataracte. Avec son arrête vive, la conception de cet implant lutte efficacement contre les problèmes
d’OCP et permet d’en réduire la fréquence, même si certains patients restent susceptibles de
connaître une OCP cliniquement marquée après leur intervention chirurgicale.
Calcification des implants :
Plusieurs rapports font état, presque exclusivement chez des patients diabétiques, d’une calcification
des lentilles intraoculaires au cours de la période postopératoire.
Traitement au laser :
Orientez précisément le faisceau laser sur le site d’intervention situé derrière la lentille. Toute
orientation du faisceau laser directement sur l’implant endommagera la lentille.
Lentilles multifocales :
Un certain nombre d’effets visuels peuvent être constatés en raison de la superposition d’images
nettes et floues, notamment une perception de halos ou lignes radiales autour des sources de
lumière dans des conditions de faible luminosité. Une diminution de la sensibilité aux contrastes par
rapport à un implant monofocal est également susceptible d’être constatée par certains patients,
d’autant plus dans des conditions de faible luminosité.
Aussi, les patients porteurs de lentilles multifocales doivent conduire avec prudence la nuit ou dans
des conditions de faible visibilité. Il incombe au médecin de prendre en considération les points
suivants, spécifiques à l’utilisation d’implants multifocaux :
Le chirurgien doit chercher à atteindre l’emmétropie pour obtenir des performances visuelles
optimales.
Les patients présentant un astigmatisme préopératoire (diagnostiqué par kératométrie)
supérieur à 1,0 dioptrie, ou pour lesquels un astigmatisme postopératoire de cet ordre est
craint, risquent de ne pas obtenir des résultats visuels optimaux.
Il convient de minutieusement centrer l’implant, faute de quoi le patient risquerait de
constater des troubles visuels dans certaines conditions de luminosité.
Le patient peut avoir besoin d’une période de neuroadaptation allant jusqu’à 6 mois avant de
constater tous les bénéfices d’un implant multifocal.
Interactions :
Aucune interaction directe entre l’implant intraoculaire et quelque médication que ce soit n’a été
constatée.
Toutefois, un traitement actuel ou récent aux antagonistes systémiques alpha-1a adrénergiques
(p. ex., Tamsulosine) est susceptible d’accentuer le risque de complications périopératoires d’une
chirurgie de la cataracte.
L’utilisation d’anticoagulants ou antiplaquettaires augmente également les risques hémorragiques et
anesthésiques ainsi que les complications périopératoires associées à la chirurgie de la cataracte.
Dans des conditions environnementales raisonnablement prévisibles, aucune interaction significative
ni aucun dommage potentiel provoqués par une exposition à des champs magnétiques, à des
influences électriques externes, à des décharges électrostatiques, à une pression ou des variations de
pression, à des sources d’ignition thermiques ou à une accélération n’ont été constatés.
Information du patient :

IFU / Instructions d’utilisation 5 / 9 Rév. 2015-06-12
Le chirurgien en charge de l’implantation doit informer le patient sur l’implant et les risques et effets
secondaires connus. Le patient doit être invité à informer le médecin de tout effet secondaire
survenant après l’implantation.
Carte patient :
Les informations importantes doivent être renseignées sur la carte patient fournie. L’un des
autocollants sur lesquels figurent les détails de l’implant (voir le jeu d’étiquettes fourni) doit être
apposé au dos de la carte patient. Cette carte doit être remise au patient avec instruction d’en
prendre soin et de la présenter à tout ophtalmologiste consulté ultérieurement.
Manipulation :
Vérifiez l’étiquette figurant sur l’emballage pour vous assurer qu’il s’agit du modèle de
lentille adéquat, qu’il présente une puissance adaptée et que sa date de péremption n’a pas
été atteinte.
Il est recommandé de conserver la lentille à température ambiante un jour avant
l’implantation.
Ouvrez la poche / l’emballage-coque au niveau de l’extrémité marquée, sortez-le et ouvrez-le
en dévissant le couvercle dans le sens contraire des aiguilles d’une montre dans des
conditions d’asepsie.
Assurez-vous que toutes les informations correspondent (modèle, puissance et numéro de
série) entre les détails fournis sur l’étiquette apposée sur le récipient, l’emballage primaire et
la boîte pliante.
Vérifiez que le modèle d’implant et la puissance correspondent aux résultats des examens
biométriques effectués avant l’intervention.
Mettez de côté le récipient et l’eau qu’il contient. Tenez le porte-lentille fixé au bouchon à vis
à la verticale, la lentille vers le haut.
Rincez soigneusement la lentille avec une solution d’irrigation intraoculaire stérile (BSS)
avant de l’implanter ou de l’introduire dans le système d’injection.
Prenez garde de ne pas abîmer la lentille.
Injectez la lentille en exerçant une pression constante et ininterrompue.
Dispositifs d’implantation :
Utilisez l’injecteur 1stInject 2,0 HB pour l’implantation de cette lentille.
Si vous utilisez un kit d’injection 1stQ à usage unique, transférez de manière aseptique le corps de
l’injecteur, la cartouche, le matériau viscoélastique nécessaire et le récipient stérile contenant la
lentille jusqu’à la zone stérile de la salle d’opération.
Pour le chargement de la lentille dans le système d’injection et l’injection en elle-même,
reportez-vous aux instructions d’utilisation du système d’injection.
L’utilisation d’une solution saline équilibrée en tant que lubrifiant n’est pas appropriée dans
cette situation.
N’utilisez pas de solution viscoélastique cohésive pour l’implantation d’une lentille
intraoculaire hydrophobe.
Chargez délicatement la lentille en veillant à ne pas la coincer ni l’abîmer.
Injectez délicatement la lentille en exerçant une pression constante et ininterrompue.
Complications pré, péri et postopératoires et effets indésirables :
 6
6
 7
7
 8
8
 9
9
1
/
9
100%