intérêt du monoxyde d`azote dans la défense anti

7
Bull. Soc. Pharm. Bordeaux, 1999, 138, 7-17
INTÉRÊT DU MONOXYDE D'AZOTE DANS LA
DÉFENSE ANTI-PARASITAIRE DES
MACROPHAGES HUMAINS (*)
M. Djavad MOSSALAYI (1), Martine APPRIOU (1)
Au cours des helminthiases, l'augmentation de
l'expression du récepteur de faible affinité pour l'IgE
(CD23/Fc
ε
RII) par les macrophages et/ou des taux élevés
d'IgE circulants ont été décrits, mais leur rôle dans la
protection de l'hôte ou dans l'évolution de la maladie n'est
pas encore entièrement élucidé.
Récemment, il a été démontré que la stimulation du
CD23 provoquait la mort intracellulaire des parasites du
genre Leishmania dans les macrophages humains, ce
phénomène mettant en jeu la production du TNF
α
et de NO.
En se basant sur plusieurs études, aussi bien in vitro
qu’in vivo, de leishmaniose cutanée humaine, nous allons
discuter, dans ce travail, d’un modèle de réponse immunitaire
qui entraîne la libération du NO, dépendante de la liaison
CD23-IgE, au cours de la leishmaniose cutanée, aussi bien
dans sa protection qu'au stade évolutif.
(*) Manuscrit reçu le 2 Décembre 1999.
(1) Laboratoire d’Immunologie et Parasitologie, UFR Sciences Pharmaceutiques,
Université Bordeaux Victor Segalen 2, Bordeaux, France e-mail :

8
Mots-clés : CD23, IgE, leishmaniose, macrophage, monoxyde d'azote.
MACROPHAGES
ET INFECTION À LEISHMANIE
Suite à une infection bactérienne ou parasitaire, les macrophages
tissulaires ou sanguins constituent la première ligne de défense non
spécifique, car il ont pour fonction de phagocyter ces agents et de présenter
leurs antigènes aux lymphocytes initiant ainsi une réponse plus au moins
spécifique de ces cellules [1-2]. Certains de ces agents infectieux pénètrent et
s'installent dans les macrophages et développent ainsi des pathologies plus
agressives. Ces micro-organismes sont : Leishmania, Trypanosoma cruzi,
Toxoplasma gondii, l’agent de la Lèpre lépromateuse, Listeria
monocytogenes, Mycobacterium avium, Candida albicans, Theileria
parvum, etc. [1]. La survie de ces parasites à l'intérieur des macrophages
montre que ces agents ont survécu à l'action lytique exercée par
l'environnement intra-cytoplasmique (pH acide 4,5-5,0, enzymes
lysosomiales, hydrolases, etc.). Lorsque l'agent ne peut être éliminé par
l’activité anti-microbienne non-spécifique, une réponse spécifique peut être
établie, dirigée en partie par les cytokines et anticorps dérivés des
lymphocytes reconnaissant de manière spécifique les antigènes parasitaires
exprimés sur les macrophages. Cependant, un échappement de cette défense
est souvent observé, aboutissant à l'apparition des signes cliniques de ces
infections. Parmi les agents infectieux des macrophages, nous allons étudier
tout particulièrement la leishmanie.
La leishmaniose est une pathologie provoquée par des parasites
transmis à l’homme par des phlébotomes. Selon l’OMS, 12 à 14 millions de
cas sont recensés dans le monde, avec un demi-million de nouveaux cas par
an. Le traitement de la leishmaniose muco-cutanée par les sels antimoniés
ainsi que les pentamidines est peu efficace et provoque d’importants effets
secondaires [3-4]. Les parasites infectent préférentiellement les macrophages.
Cependant, le rôle des cellules immunitaires, ainsi que des nombreux

9
médiateurs qu'elles sécrètent, dans la guérison des leishmanioses ou au cours
de leur évolution, n'a pas encore été élucidé.
LA RÉPONSE IMMUNE ANTI-LEISHMANIE
Le rôle des cellules T et de leurs cytokines dans l'évolution des
leishmanioses a été très largement étudié [5]. Chez les souris, l'incapacité de
contrôler l'infestation par les leishmanies a été corrélée à l'absence de
production d'IFNγ par les cellules T spécifiques des parasites ainsi qu'à leur
échec à activer des macrophages dans le but de détruire les formes
amastigotes intracellulaires. Le TNFα provenant des macrophages, la poussée
oxydative et /ou la NO synthase inductible fonctionnelle (NOSi ou NOS de
type II) semblent être essentiels dans l'élimination des parasites de ces
cellules [5].
La réponse immunitaire humaine contre l'infection à Leishmania a été
décrite en détail par de nombreux auteurs. Des modèles expérimentaux ont
nettement démontré des antigènes spécifiques de Leishmania dans
l'induction des réponses immunitaires, à la fois par les cellules TCD4+ et
TCD8+ [
2]. L'IFNγ, les lipopolysaccharides et/ou le TNFα peuvent
augmenter l'activité leishmanicide in vitro des monocytes/macrophages
humains. Cependant, le mécanisme exact de la mort des leishmanies n'a pas
été clairement démontré et, jusqu'à récemment, on ne savait pas si le NO était
impliqué dans les fonctions macrophagiques humaines.
L'activité leishmanicide des macrophages humains infectés par L.
major ou L. infantum a été observée après leur activation in vitro par de
nombreux facteurs, comprenant l'IFNγ, ou par le pontage de l'antigène
activateur CD23/FcεRII [1,6]. En attendant d'élucider le rôle des IgE, du
CD23 et des facteurs pro-inflammatoires au cours de l'infection par
Leishmania, nous avons comparé l'expression in vivo de plusieurs
médiateurs, comme l'ont rapporté plusieurs groupes, et leur effet sur l'activité
leishmanicide in vitro des macrophages humains.

10
LE CD23 ET L'ACTIVITÉ LEISHMANICIDE DES
MACROPHAGES HUMAINS
La synthèse d'IgE et l'expression du CD23 sont modifiées au cours des
parasitoses mais les mécanismes sont peu ou pas connus. De nombreuses
données démontrent maintenant une rapide expression in vivo du gène codant
pour l'IL-4 pendant l'activité anti-microbienne. L'IL-4, comme l'IL-13,
provoque l'expression du gène de l'IgE, tandis que l'expression de l'ARNm
du CD23 par les cellules humaines est fortement induite par l'IFNγ, l'IL-4 et
l'IL-13 et nécessite l'activation des kinases Janus et l'activité Stat6 [7]. La
ligation du CD40 induit également l'expression du gène du CD23, en partie
grâce à l'activation d'un membre de la famille des facteurs associés au
récepteur du TNFα [7].
L'analyse in situ d'une peau enflammée au cours d'une leishmaniose
cutanée nous a permis de détecter une expression relativement importante du
gène du CD23 en comparaison avec la peau humaine normale [2,8].
L'isoforme b de l'antigène CD23 appartient à la famille des lectines de type C
et est un antigène d'activation exprimé par les macrophages humains, de
singes et de rats, mais il n'a pas été détecté chez les souris. Comme plusieurs
antigènes majeurs de surface dans les maladies infectieuses, le domaine
lectine du CD23 semble réagir avec le fucose et le mannose [7]. La stimulation
du CD23 par les complexes immuns IgE et anti-IgE (IgE-IC) ou par des
anticorps monoclonaux spécifiques, réagissant avec le même épitope que
l'IgE, a montré qu'il peut induire une réponse pro-inflammatoire de la part
des macrophages humains et de rats [6,7]. Les cellules dont le CD23 a été
stimulé produisent du TNFγ, de l'IL-6, de l'IL-1, du thromboxane β2 et de
nombreux intermédiaires oxygénés [9]. L'addition, sur des macrophages
infectés par Leishmania, d'IgE-IC ou d'anticorps monoclonaux anti-CD23 a
comme résultat l'élimination de nombreuses formes intracellulaires de
L. major, L. infantum et L. braziliensis. Un effet similaire, mais moins
puissant, a été observé avec les cellules infectées traitées par de l'IFNγ. En
outre, la stimulation du CD23 de cellules saines les protège d'une
contamination ultérieure par L. major, alors que le prétraitement par l'IFNγ
n'a pas un tel effet [6].

11
CORRÉLATION DES RÉSULTATS IN VIVO
ET IN VITRO
L'analyse de l'expression des cytokines au cours des leishmanioses
cutanées et cutanéo-muqueuses humaines, bien que principalement limitées à
des zones endémiques restreintes, a montré une bonne corrélation entre
l'expression des cytokines in vivo, l'évolution de la maladie et l'effet de ces
mêmes cytokines sur l'activité leishmanicide des macrophages humains
[2,10]. Nos études suggèrent que deux voies indépendantes peuvent
contribuer à l'activité leishmanicide des macrophages humains infectés in
vitro : (a) via le récepteur de l'IFNγ et (b) via la ligation du CD23. Les deux
voies sont capables d'induire la production de TNFα et de NO par les
macrophages humains infestés, ces deux facteurs étant impliqués dans la
destruction de L. major par ces cellules. Cependant, le TNFα ne peut pas
induire la destruction directe in vitro de L. major par les macrophages.
Quand les macrophages ont été stimulés par l'IFNγ ou l'anti-CD23
seul, l'addition d'IL-4 ou d'IL-10 recombinants réduit de façon significative
l'activité leishmanicide in vitro. Il est intéressant de noter que l'activation des
macrophages par les deux voies CD23 et IFNγ les protège de l'effet inhibiteur
de l'IL-4 et/ou de l'IL-10 [11]. Ces résultats suggèrent que les cytokines
inhibitrices ne peuvent pas éliminer l'activité leishmanicide effective des
macrophages humains quand les deux voies en synergie, IFNγ et CD23, ont
été activées. Ceci est exactement en corrélation avec les types de cytokines
mises en évidence in vivo au cours des réponses immunitaires effectrices
observées avant la guérison ou durant les manifestations de l'hypersensibilité
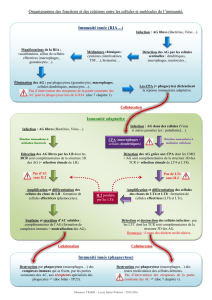
de type retardé (Figure 1).
In vitro, en absence d'IFNγ, la combinaison IL-4, IL-10, IgE-antigène
et TNFα n'arrive pas à induire l'élimination des Leishmania des
macrophages humains infectés et ceci est en corrélation avec l'expression in
vivo de ces facteurs pendant l'aggravation de la maladie [2,8]. Ces résultats
suggèrent que la maladie active peut être en rapport avec des taux élevés d'IL-
10 et de faibles taux d'IFNγ in vivo, alors que des taux élevés d'IL-4 ne sont
pas toujours en rapport avec l'évolution de la maladie. Ainsi, l'expression
continue et paradoxale d'IL-4 in vivo au cours de l'infection à Leishmania
peut être expliquée par ces effets opposés ; indirectement, en induisant
l'activité leishmanicide grâce aux IgE et à l'induction du CD23 ou,
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%