03/10/2013 WINNICKI Camille L2 Tissus sanguin et système

TISSUS SANGUIN- Les explorations lymphocytaires
03/10/2013
WINNICKI Camille L2
Tissus sanguin et système immunitaire
Pr. Robert
8 pages
Les explorations lymphocytaires
Plan
A. Introduction
I. Quand explorer les lymphocytes?
En cas de
•Défaut de fonction: déficits immunitaires
◦Acquis (le plus souvent)
◦Innés
•Exces de fonction
◦Auto immunité
◦Allergie
•Suivi thérapeutique
◦Traitement avec des anticorpes monoclonaux afin de suivre les fonctions des leucocytes
•Au CHU : recherche clinque
II. Principe des explorations
•explorations phenotypiques : les plus courantes
•explorations non fonctionelles : compter les celllules ( le = fqt )
•explorations fonctionelles : plus rares plus compliquées
B. Phénotypage lymphocytaire
I. connaître le type de cellule
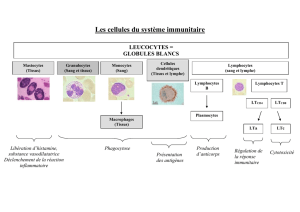
La première chose à savoir est de connaître le type de cellule
•Différencier les T, B ou NK (afin de savoir si le patient n'a pas
d'exces/défaut)
•Compter les sous populations ( vérifier leur capacité d'activation)
-Naïves, mémoire
1/8
A. Introduction
I. Quand explorer les lymphocytes ?
II. Principe des explorations
B. Phénotypage lymphocytaire
I. connaître le type cellulaire
II. Comment classer les lymphocytes ?
III. Aspects techniques
IV. Résultats
C. Tests fonctionnels
I. Isolation lymphocytes/monocytes
II. Activation des lymphocytes
III. Fonction des Lymphocytes B
IV. Phagocytes

TISSUS SANGUIN- Les explorations lymphocytaires
Connaître la quantification des récepteurs membranaires :
•Compter ce qu'exprime chaque type cellulaire ( si les lymphocytes T
expriment bien leur TCR, les Natural Killer ( NK) leur Recepteur FC
aux Ac et les Lymphcytes B ( LB) leur CD )
II. Comment classer les lymphocytes ?
En fonction de :
–leur fonction
–leur détection par des anticoprs fluorescents
–leur récepteurs membranaires (qui reflètent leur fonction)
Le lymphocyte est ici une cellule au repos, avec un gros noyau coloré en violet et un petit cytoplasme.
Il existe cependant un problème pratique : on a besoin de techniques particulières pour différencier les
différents types cellulaires. En effet, lors d'un frottis en microscopie optique à coloration classique, il est
impossible de distinguer les différentes classes de lymphocytes les unes par rapport aux autres.
La distinction des types cellulaires va se faire par leurs molécules membranaires qui vont être détectées pas des
AC monoclonaux marqués. L'utilisation des AC monoclonaux constitue une réelle revolution de la biologie
( pratiqué depuis une trentaine d'année ) car c'est une méthode quasi infaillible pour distinguer les protéines de
surfaces.
Rappel :AC monoclonal = AC codé par un seul type de lymphocyte. Les AC monoclonaux d'un lymphocyte
particulier reconnaitront le même epitope ( même partie) de l'antigène.
Premier problème : avant, il fallait mesurer les propritétés biophysiques et chimiques des différents protéines
afin de les distinguer ( migration; calcul de la charge ) sauf que les propriétés de celles-ci sont extrêmement
proches les une des autres ( même charge, même poids ).
Deuxième problème : Pour compter les leucocytes, il faut compter un nombre suffisant de chaque type pour
avoir un résultat représentatif de la population du patient. L'échantillon doit donc être suffisament gros pour
avoir une population représentative. Or, dans un frottis sanguin on a seulement quelques centaines de
leucocytes ( 60 T , 30 B, 10NK). La fluctuation est importante donc le compte pas très juste. De plus cette
technique était extrèmement chronophage ce qui entrainait une baisse de rendements considérable.
2/8
Hématie
Leucocyte non identifiable

TISSUS SANGUIN- Les explorations lymphocytaires
De nos jours, un appareil est utilisé : le cytomètre qui détecte le passage de chaque cellule et pourra mesurer
l'expression de chaque marqueur ( chaque marqueur correspondant à une couleur ).
III. Aspects techniques
Le cytomètre permet de détecter le passage de chaque cellule ( comptage des cellules) ainsi que de mesurer
l'expression de chaque marqueur ( distinction des différents types cellulaires).
Principe : (à connaître, c'est très important)
•Dilution extrème des cellules (grace à une solution isotonique) qui passent dans un tube puis une par
une devant le détecteur. Les cellules sont séparées longitudinalement car le tube possède un diamètre
supérieur à celui des cellules. C'est comme si le liquide était étiré.
•Excitation de la fluorescence par un laser
•Detection de l'émission de fluorescence par
◦Jeu de filtres colorés ( « tri » des couleurs)
◦Photomultiplicateurs ( détection de chaque couleur)
◦Astuce de distinction des monocytes et lymphocytes : un dernier photomultiplicateur
réceptionne la même longeur d'onde que celle émise lors de l'excitation. On sait que plus
la cellule a de particules dans son cytoplasme, plus la lumière est diffractée donc déviée
et récupérée sur le coté. Plus la cellule est grosse, plus la lumière est atténuée. Ainsi on
distingue
➔Le lymphocyte : cellule quiescente dans le sang qui s'active soit dans les
ganglions soit dans les tissus enflammés. Il a donc un petit cytoplasme et
un gros noyau
➔Le polynucléaire neutrophile, à l'inverse, possède deja un stock de
molécules effectrices et va avoir un noyau plutôt gros avec de nombreuses
vésicules.
➔Le monocyte: cellule phagocytaire mais qui n'obtient ses fonctions
qu'après activation. Sa taille cellulaire est intermédiaire ainsi que sa
granulométrie.
3/8

TISSUS SANGUIN- Les explorations lymphocytaires
Donc taille polynucléaire > taille monocyte > taille lymphocyte.
Ce qui nous permet de détecter par exemple que si la cellule brille en rouge, on détecte la CD3, en vert la CD4
et si on repère les deux, on met en évidence la présence d'un Lymphocyte T4.
IV. Résultats de la machine
Le résultat se présente sous forme de graph à deux dimensions où chaque point correspond aux données d'une
seule cellule.
Abscisse : mesure de l'intensité fluorescente de CD3
Ordonnée : mesure de l'intensité fluorescente de CD8
Pour les LB, pas de CD3 mais CD19 donc
Abscisse : mesure de CD3
Ordonnée : mesure de CD19
NK: cellule qui n'a pas CD3 ( indissociable du TcR) donc
marqueur CD16 ou CD56 ou, le plus souvent, les deux.
4/8

TISSUS SANGUIN- Les explorations lymphocytaires
On peut donc distinguer des population de cellules très faibles ; recherche de populations rares et énorme gain
de temps ( 10 000 cellule en 1 minute au lieu d'une semaine ) avec une variabilité très faible car l'échantillon est
très gros.
Marqeurs usuels :
•CD45 : marqueur leucoytaire (élimination des hématies). Les résultats peuvent être faussés par
les hématies car celles-ci, étant 10 fois plus nombreuses, peuvent être confondues en cas de
mauvaise lyse. Le CD45 ne se trouve pas sur les hématies mais enormément sur les leucocytes,
son marquage permet de valider les résultats et éviter un mauvais comptage. On peut également
éliminer les hématies par hémolyse puisqu'ils sont beaucoup plus sensibles que les leucocytes.
•CD3 : Lymphocytes T
-CD4 : T CD4+
-CD8 : T cytotoxique
•CD19 : B
•CD 56/16 : NK (ils sont CD3 négatifs)
Marqeurs spéciaux:
•Activation
– CD25 ( en + marqueur de distinction de T régulateur )
•Cellules T naives/mémoire
– CD45 RA/RO ( différence entre Tmem et Tnaif permet d'identifier les problèmes de
production. ( ex Tmem > Tnaif ). La normalité est dépendante de l'âge car dépend du
Thymus, une personne agée aura tendence à avoir Tmem>Tnaif et une personne très
jeune aura plutot Tmem < Tnaif) :
•Mesure de la clonalité des T, des Ig ( domaine du cancer) savoir si un clone est prépondérant par
rapport a un autre. Le cytomètre de flux est un moyen efficace de repérer des leucémies
( population abérante de LT )
•Tétramère
Astuce : le numéro des CD désigne un AC monoclonal et pas la protéine de surface du lymhphocyte mais son
ligand et correspond à l'ordre de découverte
C. Tests fonctionnels
I. Isolation des lymphocytes et monocytes
Gradient de centrifugation ( le Ficoll) : on sépare les différents constituants du sang en fonction de leur
densité. Le sang est déposé sur un liquide de densité intermédiaire entre celle des
mononucléaires/lymphocytes et celle des globules rouges/granulocytes. A partir de ces suspensions, on
peut réaliser des tests fonctionnels. Les globules rouges et les garnulocytes restent au fond et les
lymphocytes/monocytes se retrouvent au dessus de la solution de Ficoll.
5/8
 6
6
 7
7
 8
8
1
/
8
100%