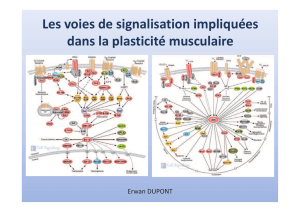
Rôle de la O-GlcNAcylation et activation de l`OGT dans l`émergence

Rôle de la O-GlcNAcylation et activation de l’OGT dans l’émergence du cancer colorectal et du sein.
Role of O-GlcNAcylation and activation of OGT in colorectal and breast cancer emergence.
Mots clés : Cancer, Prolifération, signalisation, O-GlcNAcylation.
L’O-GlcNAcylation est une modification post-traductionnelle qui touche les protéines cytosoliques et
nucléaires. Elle consiste en l’ajout d’un résidu de GlcNAc (O-linked-N-acetylGlucosamine) sur la sérine ou la
thréonine d’une protéine. La seule enzyme capable de catalyser la réaction est l’O-linked-N-acetylGlucosamine
Transférase (OGT). Il a été montré récemment que L’OGT joue un rôle important dans la croissance tumorale.
Plus particulièrement, l’inhibition de son expression ralentie la prolifération des cellules cancéreuses. Son
mécanisme d’activation est inconnu mais il a été montré qu’elle peut être phosphorylée et O-GlcNAcylée. L’un
des objectifs de mon travail, est de déterminer si la phosphorylation/O-GlcNAcylation de l’OGT peut conduire à
son activation ainsi que le ou les résidus impliqués. De plus, certaines protéines de signalisation telles que Akt
ou Erk 1/2, impliquées dans la croissance et la prolifération cellulaires normales et tumorales, peuvent être O-
GlcNAcylées lors de l’activation de leurs voies de signalisation respectives. L’autre objectif de mon travail, est
d’identifier les protéines cibles de l’OGT et de comprendre son rôle sur la régulation des voies de signalisation
Akt, Erk1/2, Wnt/-Caténine et mTOR dans les cancers du sein et du côlon.
O-GlcNAcylation is a post-translational modification of cytosolic and nuclear proteins that consists in addition
of O-GlcNAc (O-linked-N-acetylGlucosamine) on serine and threonine residues. The O-GlucNacylation is
catalyzed by a single O-GlcNAc Transferase, OGT. It has been recently demonstrated that OGT plays an
important role in tumor growth. Particularly, the inhibition of OGT expression decreases the cancer cell
proliferation. It has been demonstrated that OGT could be phosphorylated and O-GlcNAcylated, but its precise
mechanism of activation is still unknown. The first objective of the study is to determine if phosphorylation/O-
GlucNAcylation of OGT is responsible of its activation and if so we will focus on implicated residues. Moreover,
Akt and Erk1/2 signaling proteins, both implicated in normal and cancer cell proliferations, are O-GlcNAcylated
during the activation of their respective signaling pathways. The second objective of the study is to identify the
OGT target proteins and to understand the its role in regulation of Akt, Erk1/2, Wnt/-Catenin and mTOR
signaling pathways in breast and colon cancers.
1
/
1
100%