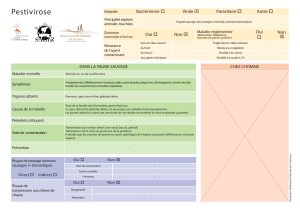
PESTE PORCINE CLASSIQUE (hog cholera)

Manuel terrestre de l’OIE 2008 1195
CHAPITRE 2.8.3.
PESTE PORCINE CLASSIQUE
(hog cholera)
RÉSUMÉ
La peste porcine classique (PPC), aussi connue sous la dénomination de hog cholera, est une
maladie virale contagieuse du porc. Le virus responsable est un membre du genre Pestivirus de la
famille des Flaviviridae, et se révèle très proche des virus de la maladie des muqueuses et de la
maladie de la frontière (Border disease). Il n’existe qu’un sérotype de virus PPC.
La maladie peut évoluer sous forme aiguë, chronique, latente, ou inapparente selon divers facteurs
tenant au virus ou à l’hôte, parmi eux l’âge de l’animal, la virulence de la souche virale et la période
d’infection (pré- ou post-natale) jouent un rôle prépondérant. Les porcs adultes sont moins
sévèrement atteints que les jeunes et ont de meilleures chances de survie. Chez les truies
gestantes, le virus peut traverser la barrière placentaire et atteindre les fœtus. L’infection in utero
par des souches virales de basse ou faible virulence peut aboutir à ce que l’on a appelé le
syndrome de la « la truie porteuse », entraînant une mortalité pré-natale ou post-natale précoce, la
naissance de porcelets malades ou d’une portée en apparente bonne santé mais infectée de façon
persistante. Une épizootie de PPC a des répercussions lourdes sur le commerce des porcs et de
leurs produits.
Le tableau clinique très polymorphe de la PPC interdit le plus souvent la réalisation d’un diagnostic
purement clinique ou lésionnel. Les méthodes de laboratoire sont alors essentielles pour un
diagnostic précis. La mise en évidence du virus ou de l’acide nucléique dans le sang et des
anticorps dans le sérum, constituent les méthodes de choix du diagnostic de la PPC chez le porc
vivant, tandis que la recherche du virus, de l’acide nucléique ou de l’antigène dans des
prélèvements d’organes, est de loin préférable quand le porc est mort.
Identification de l’agent pathogène : l’immunofluorescence (IF) appliquée sur des coupes au
cryostat d’organes provenant de porcs atteints, peut être utilisée pour la détection de l’antigène
PPC. Une série d’anticorps monoclonaux (AcMs) est utilisée pour déterminer si la fluorescence est
due à des antigènes pestivirus PPC ou non PPC. L’amplification en chaîne par polymérase (PCR)
est utilisée couramment pour la détection du génome du virus de la PPC. L’isolement du virus PPC
peut être tenté sur la lignée cellulaire de rein de porc (PK-15) ou sur une autre lignée sensible. La
production virale en culture de cellules est recherchée par coloration en immunofluorescence ou
immunoperoxydase ; les isolats positifs sont ensuite caractérisés grâce aux AcMs et par un
séquençage génétique partiel. Les protocoles de PCR pour l’identification de l’acide nucléique du
virus PPC sont acceptés au niveau international et sont utilisés dans plusieurs laboratoires tant
pour la détection du virus que pour le différencier des pestivirus des ruminants. Des épreuves
immuno-enzymatiques de capture d’antigène (ELISA) sont aussi très utiles pour le dépistage des
élevages mais ne doivent pas être utilisées pour le diagnostic d’un animal isolé.
Épreuves sérologiques : la recherche des anticorps spécifiques du virus est particulièrement utile
dans les élevages suspectés d’être infectés depuis au moins 21 jours, par le virus de la PPC. Les
méthodes sérologiques sont aussi valables pour les enquêtes de contrôle et de détermination de
prévalence ; elles sont essentielles si un pays souhaite être reconnu internationalement comme
indemne de la maladie en l’absence de vaccination.
Dans la mesure où des réactions croisées avec des anticorps Pestivirus de ruminants sont parfois
rencontrées chez les porcs d’élevage, les épreuves de dépistage doivent être complétées par des
épreuves de confirmation spécifiques du virus PPC. L’ELISA est relativement spécifique du virus

Chapitre 2.8.3. — Peste porcine classique (hog cholera)
1196 Manuel terrestre de l’OIE 2008
PPC, mais la méthode définitive de différentiation est l’épreuve de neutralisation comparative qui
compare le titre en anticorps vis-à-vis des différentes espèces de Pestivirus.
Spécifications applicables aux vaccins et aux produits biologiques à usage diagnostique :
les vaccins contre la PPC utilisent des virus vivants atténués par passages sur cultures de cellules
ou sur des espèces réceptives qui ne sont pas de la famille des suidés. La production de ces
vaccins à virus vivants modifiés repose sur la validation du système lot-semence tenant compte de
l’identité virale, de la stérilité, de la pureté, de l’innocuité, de la non transmissibilité, de la stabilité et
de l’immunogénicité. Si le virus PPC est utilisé pour la production de vaccin ou lors d’épreuves
virulentes, les locaux doivent répondre aux normes de confinement de l’OIE correspondant aux
agents pathogènes du groupe 4.
Des vaccins inactivés de type conventionnel, impliquant le virus entier, ne sont pas disponibles.
Des « vaccins sous-unitaires marqués » sont maintenant disponibles, qui, à la différence des
vaccins à virus vivants atténués, induisent des anticorps qui peuvent être distingués de ceux induits
par le virus naturel en utilisant une épreuve de diagnostic appropriée. Les « vaccins marqués »
proposés à l’heure actuelle, utilisent la glycoprotéine majeure de l’enveloppe (E2-sous-unité) du
virus PPC et sont produits sur cellules d’insecte grâce à la méthodologie de recombinaison de
l’ADN.
A. INTRODUCTION
Les virus responsables de la peste porcine classique (PPC), de la diarrhée virale bovine (BVD, Bovine Viral
Diarrhoea ou maladie des muqueuses) et de la maladie de la frontière (BD, Border Disease) sont des membres
de la famille des Flaviviridae, appartenant au genre Pestivirus, et sont très proches au plan antigénique et
structurel. Les signes cliniques et les lésions découvertes à l’autopsie de porcs morts de PPC sont très variables
en raison de facteurs liés, à la fois au virus et à l’hôte. Bien plus, les infections congénitales de la truie par des
pestivirus de ruminants peuvent conduire à une maladie cliniquement indistinguable de la PPC (31, 33, 35).
L’atteinte de tous les groupes d’âge, accompagnée de fièvre, d’entassement, d’inappétence, d’abattement, de
faiblesse, de conjonctivite, de constipation suivie par une diarrhée et d’une démarche chancelante, sont les
signes essentiels. Plusieurs jours après l’apparition des signes cliniques, une coloration pourpre apparaît sur les
oreilles, l’abdomen et à l’intérieur des cuisses. La mort survient en 1 à 3 semaines dans la forme aiguë. Une mort
brutale, en l’absence de signes cliniques, n’est pas symptomatique de la PPC.
Dans certaines circonstances en rapport avec l’âge de l’animal et son état ainsi qu’avec la souche de virus en
cause, des atteintes subaiguë ou chronique peuvent se développer et se prolonger sur 2 à 4 semaines ou même
des mois. La forme chronique conduit à un retard de croissance avec anorexie, fièvre intermittente et diarrhée.
Les infections congénitales persistantes peuvent restées méconnues pendant des mois et peuvent être limitées à
seulement quelques porcelets de l’élevage ou affecter un grand nombre d’animaux. Les signes cliniques sont
équivoques : dépérissement apyrétique. Les infections chroniques persistantes conduisent toujours à la mort de
l’animal. Les taux de mortalité dans un élevage, peuvent être légèrement supérieurs à ceux attendus. La PPC
affecte le système immunitaire et la principale caractéristique en est une leucopénie généralisée, qui peut
souvent être détectée avant l’apparition de la fièvre. L’immunosuppression peut entraîner l’apparition d’infections
secondaires.
Dans les formes aiguës, les lésions macroscopiques peuvent être discrètes ou absentes. Dans les cas typiques,
les nœuds lymphatiques sont hypertrophiés et marbrés de rouge, des hémorragies apparaissent sur les séreuses
oui les muqueuses des organes intestinaux. Des infarctus peuvent être observés dans les reins. Dans les cas
chroniques, des ulcères nécrotiques dits « en boutons de culotte » peuvent être observés dans la muqueuse du
tractus gastro-intestinal, l’épiglotte et le larynx, en plus des lésions précédentes.
Les lésions microscopiques histologiques ne sont pas pathognomoniques. Il peut s’agir de dégénérescence
parenchymateuse du tissu lymphatique, de proliférations cellulaires du tissu interstitiel vasculaire, et d’une
méningo-encéphalomyélite non suppurée, avec ou sans manchons péri-vasculaires.
Une synthèse sur les techniques de diagnostic et la vaccination de la PPC a récemment été publiée par une
source autorisée (3) qui, outre des lignes directrices générales, apporte des informations sur la validation et un
avis scientifique sur l’applicabilité de certains produits commercialisés dans ces domaines.

Chapitre 2.8.3. — Peste porcine classique (hog cholera)
Manuel terrestre de l’OIE 2008 1197
B. TECHNIQUES DE DIAGNOSTIC
Le polymorphisme et l’intensité variable des signes cliniques et lésionnels ne permettent pas de poser un
diagnostic précis. D’autres maladies, telles que la peste porcine africaine, le syndrome dermatite et néphropathie
du porc (PDNS pour porcine dermatitis and nephropathy syndrome), le syndrome de dépérissement post-sevrage
(PMWS pour post-weaning multisystemic wasting syndrome), le purpura thrombocytopénique ainsi que diverses
infections septicémiques telles que les salmonellose (notamment celles dues à Salmonella choleraesuis), les
rougets, la pasteurellose, l’actinobacillose (due à Actinobacillus suis) et les infections à Hemophilus parasuis,
peuvent être confondues avec la PPC aiguë. En fait, ces bactéries sont souvent responsables d’infections
secondaires et, l’isolement de ces germes peut cacher la cause réelle de la maladie, le virus de la PPC. De
même, le PDNS évoluant simultanément peut occulter une PPC sous-jacente.
C’est pourquoi, une tentative de diagnostic clinique ou lésionnel doit toujours être confirmée par des recherches
de laboratoire. Étant donné que la fièvre est un des premiers symptômes de la PPC et qu’elle est concomitante
de la virémie (7), la détection du virus ou de l’acide nucléique viral dans le sang total récolté sur héparine ou
acide éthylène diamine tétra-acétique (EDTA) ou dans les tissus prélevés chez des animaux fébricitants est la
méthode de choix pour dépister précocement les élevages infectés. Cela est d’autant plus nécessaire à la vue
des lourdes conséquences que l’existence d’un foyer de PPC peut causer pour le commerce international des
porcs et de leurs produits.
Les méthodes de laboratoire pour le diagnostic de la PPC visent la mise en évidence du virus, de son acide
nucléique ou de ses antigènes ainsi que des anticorps qui lui sont spécifiques. Pour une interprétation correcte
des résultats des épreuves, le vétérinaire doit accorder une attention particulière à l’apparition simultanée et
groupée d’au moins 2 signes parmi les plus fréquents de la maladie signalés ci-dessus. La réalisation de
prélèvements au hasard ne convient pas au diagnostic. De plus, les prélèvements sanguins destinés à la
recherche du virus et les réactions de transcription inverse et d’amplification en chaîne par polymérase (RT-PCR)
peuvent être réalisés sur un nombre plus important de porcs.
La PPC fait l’objet d’un contrôle officiel et le virus présente un haut risque de diffusion à partir du laboratoire : une
analyse de risque doit être effectuée pour déterminer le niveau de biosécurité nécessaire au diagnostic et à la
caractérisation du virus. Les locaux doivent répondre aux normes de Confinement correspondant au Groupe
déterminé par l’évaluation du risque comme cela est souligné dans le Chapitre 1.1.2., « Biosécurité et Biosûreté
au laboratoire de microbiologie vétérinaire et dans les animaleries », de ce Manuel terrestre. Les pays ne pouvant
avoir accès à un tel laboratoire national ou régional, devront adresser les prélèvements à un Laboratoire de
référence de l’OIE.
Les anticorps apparaissent durant la troisième semaine d’évolution de la maladie et persistent toute la vie chez
les sujets survivants. Les prélèvements destinés à la recherche des anticorps sont effectués dans des tubes
ordinaires non héparinés, chez les porcs convalescents et chez les porcs de l’élevage qui ont été en contact avec
le virus, au moins 3 semaines après que le contact avec un foyer avéré a eu lieu.
1. Identification de l’agent pathogène
a) Méthodes immunologiques
• Épreuve d’immunofluorescence
L’immunofluorescence (IF) est rapide et peut permettre de détecter l’antigène du virus PPC sur des coupes
au cryostat d’amygdale, de rate, de rein, de nœud lymphatique ou de portion distale de l’iléon. Les tissus
doivent être prélevés sur plusieurs animaux fiévreux et/ou malades (4) et transportés sans conservateur,
sous froid mais non congelés. Les coupes au cryostat sont colorées directement avec une immunoglobuline
anti-PPC conjugué à l’isothiocyanate de fluorescéine (FITC) ou indirectement à l’aide d’un conjugué FITC
secondaire puis examinées au microscope à fluorescence. Au début de l’infection, le tissu amygdalien est le
plus propice car il est le premier à être infecté par le virus quelle que soit la voie de pénétration (25). Dans
les cas subaiguës ou chroniques, l’iléon est souvent positif et, parfois, constitue le seul tissu révélant une
fluorescence. Un résultat négatif en IF ne peut permettre d’éliminer l’infection PPC. Lorsque la suspicion de
PPC persiste, il doit être réalisé d’autres prélèvements ou des essais d’isolement du virus en cultures de
cellules (par exemple sur rein de porc [PK-15] ou sur d’autres lignées d’origine porcine aussi sensibles et
reconnues exemptes de contamination par un Pestivirus).
Dans les laboratoires qui ne maîtrisent pas parfaitement la technique IFI, les risques de faux résultats
(positifs ou négatifs) sont relativement élevés. L’IFI devrait donc être utilisée uniquement dans les
laboratoires ayant une bonne expérience de cette méthode, qui la réalisent en routine et dont le personnel a
été formé à l’interprétation de la fluorescence.

Chapitre 2.8.3. — Peste porcine classique (hog cholera)
1198 Manuel terrestre de l’OIE 2008
• Protocole
Introduire des coupes témoins positif et négatif dans chaque série de prélèvements d’organe à examiner.
i) Découper un fragment d’amygdale, de rate, de rein et d’iléon d’environ 1 × 1 × 0,5 cm, et le placer soit
avec un composé de cryo-montage, soit avec de l’eau distillée, sur le support de tissu du cryostat.
ii) Congeler le fragment d’organe sur le support du cryostat.
iii) Effectuer des coupes ne dépassant pas 4 à 8 µm d’épaisseur et les étaler sur des lamelles
couvre-objet (10 × 32 mm) dégraissées et dont un coin est coupé. Toutes les coupes sont montées
avec le coin coupé de la lamelle dans la même direction (par exemple angle supérieur droit).
iv) Après séchage, fixer les coupes ainsi montées, pendant 10 min à la température ambiante, dans de
l’acétone (qualité analytique), ou à l’air pendant 20 min à 37 °C.
v) Immerger rapidement les coupes dans une solution physiologique tamponnée au phosphate (PBS),
éliminer le fluide en excès à l’aide d’un papier filtre, et les placer (angle supérieur coupé à droite) sur
un support dans une chambre humide dont le fond renferme une petite quantité d’eau.
vi) Répartir l’immunoglobuline anti-PPC à la dilution recommandée, sur la totalité de la surface de la
coupe et incuber pendant 30 min à 37 °C dans la chambre humide close. Si le conjugué FITC
secondaire est nécessaire, laver la coupe 5 fois, pendant 2 min chacune, dans du PBS à la
température ambiante, puis ajouter le conjugué FITC à la dilution requise et incuber comme
précédemment.
vii) Laver les coupes 5 fois, pendant 2 min chacune, dans du PBS, à la température ambiante.
viii) Éliminer le PBS restant par contact de la lamelle avec un papier filtre fin, et monter la lamelle (avec la
coupe entre la lamelle et la lame) avec un tampon de montage, sur une lame pour examen
microscopique.
ix) Éliminer l’excès de fluide de montage avec du papier filtre et examiner les coupes pour rechercher les
foyers fluorescents, en utilisant un microscope à lumière ultra-violette. Une coupe PPC-positive montre
des cellules émettant une fluorescence verte brillante. Dans les amygdales, la fluorescence de la
bordure épithéliale des cryptes est particulièrement marquée. Dans le rein, la fluorescence est plus
intense dans les tubules proximaux et distales du cortex rénal et les tubes collecteurs de la médulla.
Dans l’iléon, la fluorescence est plus accusée dans les cellules épithéliales des glandes de Lieberkün,
tandis que dans la rate, la réactivité est plus diffuse avec des concentrations de cellules lymphoïdes
dans les gaines lymphoïdes péri-artérielles (PALS).
L’IF utilise une immunoglobuline anti-PPC préparée à partir d’un anticorps polyclonal du virus PPC
incapable de distinguer les antigènes des différents pestivirus. Les conjugués utilisés pour l’IF sur les
coupes au cryostat ou les cultures de cellules inoculées, doivent être élaborés à l’aide de gamma-globulines
obtenues chez des porcs exempts d’agents pathogènes spécifiques (EAPS). La dilution de conjugué utilisée
(au moins 1/30) doit ménager un maximum de brillance sur un minimum de coloration de fond. La réaction
ne doit être réalisée que sur des échantillons prélevés sur des animaux morts depuis peu, car l’autolyse et la
contamination bactérienne entraînent souvent une coloration parasite.
Les souches vaccinales de virus vivant modifié (VVM) se multiplient surtout dans les nœuds lymphatiques
régionaux et dans l’épithélium des cryptes amygdaliennes. Les porcs vaccinés avec des souches VVM
peuvent produire une IF positive durant les 2 semaines suivant la vaccination (22, 28). L’inoculation du lapin
est utilisée pour différencier les souches de PPC lapinisées des souches sauvages. À l’opposé des souches
sauvages, les souches lapinisées, inoculées par voie intraveineuse, entraînent une réaction fébrile et
induisent une réponse immunitaire chez le lapin. Maintenant que le séquençage de l’acide nucléique est
devenu une technique fiable, l’inoculation aux animaux n’est plus nécessaire pour faire la distinction entre
les souches sauvages et les souches vaccinales du virus de la PPC.
Les porcs infectés par les pestivirus des ruminants peuvent donner, en IF, des réactions faussement
positives. Les infections congénitales dues aux pestivirus des ruminants peuvent entraîner des signes
cliniques et des lésions identiques à ceux et à celles de la PPC chronique (31, 33, 35). Les infections par le
virus PPC ou les pestivirus des ruminants peuvent être différenciés en soumettant les sérums de la truie et
de la portée, ou des autres sujets en contact avec un porcelet IF positif, à une épreuve de séroneutralisation
vis-à-vis de chacun des virus. Si le virus a été isolé, ou si l’acide nucléique a été détecté à l’aide de la
RT-PCR, un séquençage ultérieur représente un outil précis et rapide pour faire la distinction entre les
pestivirus des ruminants et le virus de la PPC. Une autre méthode de différentiation de ces virus consiste en
l’inoculation de porcelets séronégatifs avec une suspension du matériel suspect, suivie, 4 semaines plus
tard au moins, d’épreuves de séroneutralisation pratiquées sur leur sérums pour la recherche des anticorps
respectifs. Cependant, les épreuves de séroneutralisation peuvent prendre plusieurs jours et les méthodes
d’inoculation à l’animal réclament plusieurs semaines.

Chapitre 2.8.3. — Peste porcine classique (hog cholera)
Manuel terrestre de l’OIE 2008 1199
• Épreuve d’immunoperoxydase pour la différentiation des pestivirus par les anticorps monoclonaux
Le recours à une série de 3 anticorps monoclonaux (AcMs), soit conjugués à la peroxydase de raifort
(HRPO) ou à l’isothiocyanate de fluorescéine (FITC), soit utilisés en association avec un conjugué
anti-souris et détectant de façon spécifique respectivement toutes les souches PPC sauvages, les souches
vaccinales PPC et les pestivirus des ruminants, permettrait une différentiation précise entre les souches
sauvages et vaccinales PPC, d’une part, et entre virus PPC et les autres pestivirus, d’autre part (11, 36, 38).
Une condition essentielle est que l’AcM anti-virus PPC reconnaisse toutes les souches sauvages et que
l’AcM anti-vaccin reconnaisse toutes les souches vaccinales utilisées dans le pays. Aucun AcMs ne réagit
sélectivement avec tous les pestivirus de ruminants (11). Le recours à un AcM différenciant la souche
vaccinale PPC n’est pas nécessaire dans les zones où l’on ne vaccine pas. Une immunoglobuline
polyclonale anti-PPC conjuguée à la peroxydase (HRPO) sert de témoin positif. Des précautions doivent
être prises lorsque l’on utilise un seul AcM en confirmation unique de la nature PPC d’un isolat.
• Protocole
i) Réaliser au cryostat au moins 8 coupes (4 à 8 µm) d’amygdale positive en IF ou d’un autre organe
positif si l’on ne dispose pas d’amygdale.
ii) Fixer les coupes sur des lamelles couvre objet dans l’acétone (qualité analytique) pendant 10 min et
laisser sécher à l’air.
iii) Préparer des dilutions appropriées des différents conjugués AcMs-peroxydase en PBS + 0,01 % de
Tween 80 + 5 % de sérum de cheval, pH 7,6 (un FITC-AcMs peut aussi être utilisé, aussi bien qu’un
AcM non conjugué, pourvu qu’un second conjugué soit utilisé).
iv) Après rinçage en PBS, recouvrir 2 coupes avec la dilution des conjugués monoclonaux respectifs et
2 coupes avec la dilution du conjugué polyclonal (témoins).
v) Incuber à 37 °C pendant 1 h en chambre humide.
vi) Laver les coupes pendant 10 s, 6 fois, en PBS.
vii) Colorer les coupes avec la solution de substrat chromogène1 fraîchement préparée, pendant 5 à
15 min à température ambiante.
viii) Rincer les coupes dans une solution en eau distillée d’acétate de sodium 0,05 M, pH 5,0, et les monter
sur des lames pour examen microscopique.
ix) Examiner les coupes au microscope. Une coloration rouge foncé du cytoplasme des cellules
épithéliales bordant les cryptes amygdaliennes indique la mise en évidence d’un virus par le conjugué
correspondant et est considéré positive.
x) Interprétation de l’épreuve :
Anticorps
polyclonale
Anticorps monoclonal spécifique de Interprétation
Souche PPC Souche vaccinale
PPC
Souche BVD/BD
! ! – –
Souche sauvage PPC
! ! ! – Souche vaccinale PPC
! – – ! Souche BVD/BD
! – – –
Autre pestivirus non-PPC*
* L’existence de nouvelles souches de PPC doit toujours être prise en compte et tout isolat de cas où la PPC est
encore suspectée doit être envoyé à un Laboratoire de référence de l’OIE.
1 Solution de substrat chromogène
A. Solution stock de chromogène : 0.4 % de 3-amino-9-ethyl carbazole ; N,N-dimethyl-formamide (1 ml).
Prendre garde aux composés toxiques. Les deux produits chimiques sont cancérigènes et irritants pour les yeux, la
peau et l’appareil respiratoire.
B. 0,05 M d’acétate de sodium, pH 5,0 ; 19 ml (filtré stérilement à travers une membrane).
C. Solution stock de substrat (30 % de peroxyde d’hydrogène).
Conserver les solutions stock A et C dans l’obscurité et à 4°C et la solution B à température ambiante. La solution stock A
peut être conservée à 4°C Durant au moins 6 mois et la solution C durant au moins 1 an. Juste avant d’utiliser les
solutions, diluer 1 ml de la solution A dans 19 ml de la solution B. Ajouter alors 10 µl de la solution stock C. Mélanger bien
et colorer les coupes.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%