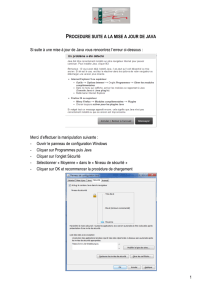
Abondance des éléments chimiques sur Terre et dans l`Univers I

Chimie
P2/CH1/TP n°7
Partie Chapitre
Constitution de la matière Modèle de l’atome
1
Abondance des éléments chimiques sur Terre et dans l’Univers
Objectifs :
- Découvrir les abondances des éléments chimiques dans le globe terrestre et dans l’univers.
- Apprendre à tracer un histogramme et un diagramme circulaire.
- Apprendre le nom et le symbole de certains éléments.
I.
Abondance des éléments chimiques
Beaucoup d’éléments chimiques sont présents sur Terre et dans l’Univers. Ils se retrouvent dans des
proportions différentes. Voici le pourcentage atomique des différents éléments présents d’abord sur Terre et
dans l’Univers [Terre/Univers] :
Oxygène : [48,8%/0,01%]
Magnésium : [16,5%/0,01%]
Fer : [14,3%/0%]
Silicium : [13,8%/0,01%]
Soufre : [3,7%/0%]
Aluminium : [1,6%/0%]
Nickel : [0,6%/0%]
Chrome : [0,2%/0%]
Hydrogène : [0,2%/90%]
Hélium : [0%/9%]
Carbone : [0,02%/0,06%]
Azote : [0%/0,01%]
Néon : [0%/0,01%]
II.
Utilisation d’un tableur
A l’aide du logiciel Excel, mettre toutes les données précédentes sous forme d’un tableau vertical.
Protocole à respecter :
- Lancer le logiciel Excel.
- Inscrire les deux NOMS et Prénoms dans la première cellule.
- Mettre un titre sur toute la largeur du tableau : « Abondance des éléments chimiques sur Terre et
dans l’Univers », le mettre en gras .
- Pour la 1
ère
colonne du tableau : « Nom de l’élément »
- Pour la 2
ème
colonne du tableau : « Symbole de l’élément »
- Pour la 3
ème
colonne du tableau : « % atomique sur Terre »
- Pour la 4
ème
colonne du tableau : « % atomique dans l’Univers »
Enregistrer le travail sur le bureau . Enregistrer régulièrement.
Pour les colonnes, ajuster leur largeur pour voir entièrement les titres des colonnes.
Faire apparaître la grille du tableau .
La largeur du tableau ne doit pas dépasser le format de la feuille en mode portrait (demander l’aperçu).
Centrer le texte dans les colonnes .
Compléter le tableau avec les données du paragraphe I. Appeler le professeur.
III.
Mise en forme des graphiques
Dans cette partie il est demandé de faire trois graphiques, deux circulaires et un histogramme. Ces diagrammes
permettent de mieux visualiser les répartitions des éléments.
Représentation en diagramme circulaire du pourcentage atomique sur Terre.
Protocole à respecter :
- Insérer un graphique. Cliquer sur ou cliquer sur Insertion
dans la barre d’outils, puis Graphique.
- Une fenêtre s’ouvre Assistant Graphique. Sélectionner Secteur
dans la liste des graphiques proposés de l’onglet types
standard. Sélectionner secteur éclaté avec effet 3D. Cliquer sur
suivant.
- Dans l’onglet page de données, sélectionner les colonnes 2, 3 et
4.
- Dans l’onglet séries, vérifier que la série sélectionnée est la
bonne. Supprimer les autres. Cliquer sur suivant.
- Vérifier que le graphique comporte bien un titre.
Chimie
P2/CH1/TP n°7
Partie Chapitre
Constitution de la matière Modèle de l’atome
2
- Cliquer sur suivant.
- Placer le graphique en tant qu’objet dans la feuille de travail.
- Cliquer sur terminer.
Le diagramme circulaire apparaît sur la feuille de travail. Appeler le professeur.
Représentation en diagramme circulaire du pourcentage atomique dans l’Univers.
Insérer un nouveau graphique. Suivre le protocole précédent.
Appeler le professeur.
Représentation en histogramme.
Protocole à respecter :
- Insérer un graphique.
- Sélectionner histogramme dans la liste des graphiques proposés de l’onglet types standard.
Sélectionner histogramme groupé avec effet 3D. Cliquer sur suivant.
- Dans l’onglet page de données, sélectionner les colonnes 2, 3 et 4.
- Cliquer sur suivant.
- Vérifier que le graphique comporte bien un titre. Légender les axes.
- Cliquer sur suivant.
- Placer le graphique en tant qu’objet dans la feuille de travail.
- Cliquer sur terminer.
L’histogramme apparaît. Ajuster sa taille pour que tous les éléments soient présents.
Appeler le professeur.
L’ensemble graphiques + tableau devra tenir dans une seule feuille en mode portrait. Utiliser l’aperçu avant
impression. Une fois le travail terminé, appeler le professeur.
IV.
Activité documentaire
Différents éléments chimiques sont recensés sur Terre et dans l’Univers, mais d’où viennent-ils ?
Pour répondre à cette question, lire le texte page 3 et répondre aux questions suivantes (en s’aidant également
du travail précédent).
Répondre aux question au dos de la feuille sur laquelle sont imprimés les graphiques.
Questions :
1) Qu’est-ce qui est à l’origine de la formation de l’Univers ?
2) Qu’elles sont les premières particules créées ?
3) Par quels procédés les noyaux légers se transforment-ils en noyau plus lourd ?
4) Quels sont les deux éléments les plus présents dans l’Univers ?
5) Quels sont les quatre éléments les plus présents sur Terre ?
6) Le nom ancien de SIAL donné à la croûte terrestre se justifie par quels éléments ?
7) Le nom ancien SIMA donné au manteau se justifie par quels éléments ?
8) Le nom NIFE donné au noyau se justifie par la présence de quels éléments ?
V.
Pour les plus rapides
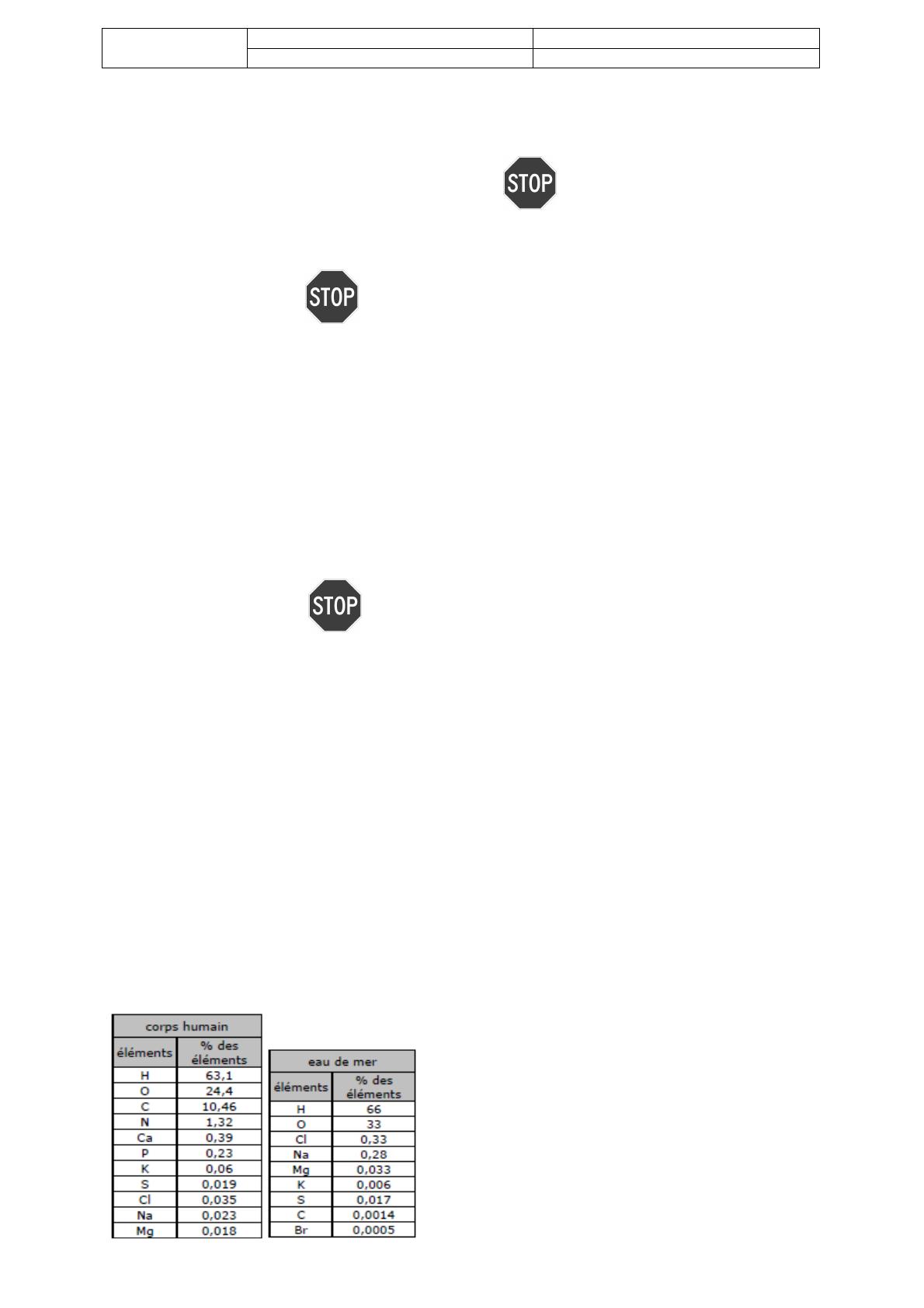
1) Justifier l’abondance des éléments H et O dans l’eau de
mer et leurs proportions.
2) Justifier la relative abondance des éléments chlore et
sodium dans l’eau de mer.
3) Où sont localisés dans le corps humain les éléments Mg
et Ca?
4) Quelle est la masse d’hydrogène, d’oxygène et de
carbone contenu dans le corps d’une personne de
75kg.

Chimie
P2/CH1/TP n°7
Partie Chapitre
Constitution de la matière Modèle de l’atome
3
Le grand chambardement
Tout aurait commencé par une gigantesque
explosion, environ quinze milliards d'années plus
tôt. Un grand boum, selon la théorie du "Big Bang".
La naissance de l'univers, l'instant zéro, reste un
mystère.
Mais quelques fractions de seconde après, 10-43 s, le
nouveau-né est chétif, moins gros que ça "•", mais a
un sacré appétit d’expansion ! Quelque peu fiévreux
aussi, des milliards de milliards de milliards... de
degrés. Enfin une énergie
considérable, déjà mise à profit
pour fabriquer des particules.
Un millionième de seconde
après, sa croissance se porte bien :
sa taille atteint 2 à 3 années-lumière
(la grosseur notre système solaire)
et la fièvre baisse : 10 000 milliards
de degrés.
Déjà une seconde et plus que
10 milliards de degrés ; c'est le
règne des photons avec quelques
protons, neutrons et électrons qui
flottent de-ci, de là.
Au bout d'une minute et quarante secondes environ,
la température est passée à 1 milliard de degrés. Les
premiers noyaux vont se former à partir des
neutrons et des protons; d’abord d'hydrogène 11H
puis de deutérium 21H et d’Hélium 42He.
Après 300 000 ans, environ 3000 degrés. Les
électrons s'associent aux noyaux pour former les
premiers atomes : atomes d'hydrogène, atomes
d'hélium.
Des atomes aux galaxies
Un grand saut, vers un milliard d'années, de
grandes masses se retrouvent rassemblées pour
constituer les galaxies. Comment ? On ne le sait pas
encore.
On en dénombre plusieurs milliards. Chacune des
galaxies est constituée d'étoiles, une galaxie
moyenne comme la nôtre compte plus de cent
milliards d'étoiles. Ce sont dans les étoiles où
règnent des températures très élevées (un million à
un milliard de degrés) que peuvent se produire des
réactions de fusion nucléaire permettant de
transformer les noyaux légers en d'autres plus
lourds, et par suite de fabriquer de nouveaux
éléments. Ainsi, durant son évolution, une étoile
consomme d'abord l'hydrogène pour le transformer
en hélium. A des températures plus élevées, la
fusion de l'hélium donne de l'oxygène et du carbone
qui, à leur tour, seront utilisés pour donner de
nouveaux éléments : sodium, néon, phosphore,
silicium ... jus
qu'au fer, le noyau le plus stable et
point final de ce processus de fusion.
Par conséquent, en vieillissant, une ét
oile
s'appauvrit de plus en plus en hydrogène et
s'enrichit en éléments lourds.
Terre !
Puis 10 milliards d'années après le Big Bang,
notre so
leil et son système planétaire se sont
constitués ; il y a donc 5
milliards d'années. Un nuage
de gaz qui s'eff
ondre sous
l'effet de la gravitation, en son
centre notre Soleil, tout autour
des grains de pous
sière qui
s’agglutinent et vont donner
nais
sance aux planètes dont la
Terre.
La Terre a la forme d'un globe,
entouré d'une couche gazeuse,
l'atmosphère (1000 km
d'épaisseur).
On peut la découper en plusieurs couches
concentriques de différente épaisseur. On distingue,
de la surface vers le centre :
- la
croûte terrestre, d'épaisseur moyenne 7 km
sous les océans, 3 à
5 km sous les continents,
composée de silice et de silicate dou
ble,
d'aluminium et de métal tel que le
sodium,
potassium, calcium, magnésium…
-
le manteau (2900 km) composé de silicates
ferro-magnésiens.
-
le noyau (3500 km) composé de nickel, fer et en
quantité moindre, de soufre et d'oxygène.
Le mouvem
ent du fer liquide dans le noyau serait à
l'origine du champ magnétique terrestre,
responsable de l'orientation des boussoles.
Et les autres éléments ?
Qu’en est-il des autres éléments, ceux qui ne sont
pas créés au sein des étoiles ?
Les éléments plus lourds que le fer sont formés lors
d’explosion de supernovæ. Effectivement, de telles
explosions engendrent des énergies beaucoup plus
importantes qui permettent la formation d’éléments
plus lourds.
Bibliographie :
Sciences et Avenir hors série n'62
Sciences et Vie Junior n'71
Eurêka n°1.
Image : Notre galaxie : la voie lactée.
1
/
3
100%