Imagerie de la perfusion et du métabolisme cérébral Brain perfusion

Réunion de neuroanesthésie–réanimation
Imagerie de la perfusion et du métabolisme cérébral
☆
Brain perfusion and metabolism imaging techniques
J.-F. Payen
a,*
, V. Lefournier
b
, E. Barbier
c
, F. Dardérian
a
, B. Fauvage
a
, J.-F. Le Bas
b
a
Département d’anesthésie–réanimation, hôpital Michallon, BP 217, 38043 Grenoble cedex 09, France
b
Service de neuroradiologie, hôpital Michallon, BP 217, 38043 Grenoble cedex 09, France
c
Inserm, UM 594, neuro-imagerie fonctionnelle et métabolique, hôpital Michallon, BP 217, 38043 Grenoble cedex 09, France
Disponible sur internet le 15 mai 2006
Résumé
Depuis plusieurs années, la mise à disposition des cliniciens de nouvelles techniques d’imagerie cérébrale a permis de mieux comprendre la
physiopathologie du cerveau, d’améliorer la performance diagnostique, voire de modifier la stratégie thérapeutique. Des gains notables dans la
résolution spatiale et temporelle rendent aujourd’hui possible l’obtention d’images de la perfusion et du métabolisme cérébral chez l’homme.
Dans cette mise au point, l’accent sera mis sur quatre techniques dont les applications médicales peuvent concerner les patients de neuroréani-
mation : la tomodensitométrie (TDM) de perfusion, l’IRM de perfusion, la tomographie d’émission de positons (PET-scan) et l’imagerie spec-
troscopique RMN. Outre leur principe théorique, chacune de ces techniques possède des avantages et des limites qu’il importe de connaître. Des
champs d’utilisation préférentielle sont possibles, en tenant compte du niveau d’information délivré par chaque technique, de son accessibilité
dans la pratique quotidienne, et de la fenêtre d’observation la plus pertinente dans l’histoire du patient.
© 2006 Elsevier SAS. Tous droits réservés.
Abstract
Due to recent efforts in improving spatial and temporal resolution in imaging techniques, it is now possible to get relevant information about
brain perfusion and metabolism in humans. This information can significantly impact on brain pathophysiology, diagnosis assessment and ther-
apy options, particularly in patients having brain ischemia. Among these imaging and metabolism techniques are dynamic perfusion computed
tomography, perfusion MRI, positron emission tomography and NMR spectroscopic imaging. The goal of this article is an overview of these four
techniques, with their own technical description, advantages and drawbacks. Details are provided about brain parameters given by each technique
and their clinical relevance, the accessibility of the technique in the emergency setting and the optimal window to use it during the patient’s
evolution.
© 2006 Elsevier SAS. Tous droits réservés.
Mots clés : Résonance magnétique nucléaire ; Tomographie d’émission de positons ; Tomodensitométrie ; Spectroscopie RMN ; Métabolisme cérébral ; Perfusion
cérébrale ; Débit sanguin cérébral ; Volume sanguin cérébral ; Temps de transit moyen
Keywords: Computed tomography; Magnetic resonance imaging; Magnetic resonance spectroscopy; Positron emission tomography; Brain perfusion; Brain
metabolism
1. Introduction
Depuis des années, un effort considérable a été effectué
dans les techniques d’imagerie afin de mieux comprendre la
physiopathologie des lésions cérébrales, d’améliorer la perfor-
mance diagnostique et, le cas échéant, d’orienter la stratégie
thérapeutique. Grâce à une résolution temporelle et spatiale
sans cesse améliorée, il est désormais possible d’obtenir des
http://france.elsevier.com/direct/ANNFAR/
Annales Françaises d’Anesthésie et de Réanimation 25 (2006) 722–728
☆
Travail présenté lors des XXVII
es
Journées de l’association de Neuroanes-
thésie-réanimation de langue française, Toulouse, les 17 et 18 novembre 2005.
*
Auteur correspondant.
Adresse e-mail : [email protected] (J.-F. Payen).
0750-7658/$ - see front matter © 2006 Elsevier SAS. Tous droits réservés.
doi:10.1016/j.annfar.2006.03.032

informations quantitatives sur la perfusion et le métabolisme
cérébral chez le patient en situation d’agression cérébrale. Le
point commun de ces techniques d’imagerie est leur caractère
non invasif, au sens où aucune implantation d’un capteur intra-
crânien n’est nécessaire pour obtenir une information sur la
perfusion ou sur le métabolisme cérébral. De nombreuses tech-
niques d’imagerie de la perfusion cérébrale existent, applica-
bles chez l’homme, dont la pertinence a été récemment analy-
sée [1]. Pour le patient en situation d’agression cérébrale
(accident vasculaire cérébral, traumatisme crânien, hémorragie
sous-arachnoïdienne), la tomodensitométrie (TDM) de perfu-
sion prend une place de plus en plus importante. D’un accès
moins facile, trois autres techniques sont possibles : l’IRM de
perfusion (gadolinium, marquage artériel), la tomographie
d’émission de positons (PET), outil d’analyse de la perfusion
et du métabolisme cérébral, et l’imagerie métabolique par spec-
troscopique RMN (SRM). Enfin, la tomodensitométrie au
xénon stable (TDM-Xe) et la tomographie d’émission mono-
photonique (SPECT) ont vu leur intérêt progressivement dimi-
nué. Le Tableau 1 résume les principales caractéristiques de
ces techniques. Les quatre premières techniques (TDM de per-
fusion, IRM de perfusion, PET, SRM) font l’objet de cette
mise au point, avec une présentation pour chacune d’elles de
son principe de fonctionnement, de ses avantages et de ses li-
mites, et de son domaine d’application clinique. Une attention
particulière sera donnée à l’accessibilité de la technique en pra-
tique quotidienne, à la qualité des informations fournies et au
meilleur moment dans l’histoire du patient de les obtenir.
2. Tomodensitométrie de perfusion
2.1. Principes généraux
Le principe de la tomodensitométrie (TDM) de perfusion est
fondé sur l’analyse de l’évolution du contraste lors du premier
passage d’un bolus intravasculaire d’un agent non diffusible,
l’iode. Une information sur des paramètres hémodynamiques
cérébraux est ainsi disponible, dont la lecture est rendue facile
par des cartes fonctionnelles en couleurs. L’acquisition se fait
grâce à un scanner en mode dynamique, à raison d’une à quatre
coupes jointives pendant 40 secondes (une image par seconde
ou toutes les deux secondes), pendant l’injection périphérique
intraveineuse d’un agent de contraste iodé (40 ml) à un faible
débit d’injection (4 ml/s). Le logiciel de perfusion permet à
l’utilisateur de traiter une série temporelle d’images dynami-
ques, à partir de l’évolution de la valeur des unités Hounsfield
de chaque voxel pendant l’administration de l’agent de
contraste. Des paramètres de la perfusion cérébrale sont calcu-
lés selon un modèle mathématique (pente maximale, volume
central) en ayant défini une fonction d’entrée artérielle (le si-
gnal en provenance d’une artère dans l’image, généralement
l’artère cérébrale antérieure) et/ou une fonction de sortie vei-
neuse (généralement le sinus sagittal supérieur) du produit de
contraste. Les quatre paramètres essentiels de la perfusion cé-
rébrale sont : le temps de transit moyen (TTM, en secondes), le
volume sanguin cérébral (VSC, en ml/100 g de tissu), le débit
sanguin cérébral (DSC, en ml/100 g de tissu par minute), le
temps du pic maximal de contraste (TTP, en seconde). Le
DSC est calculé à partir de la mesure du TTM et du VSC,
selon l’équation : DSC = VSC/TTM. Une zone d’hypoperfu-
sion cérébrale se traduit alors par un allongement du TTM,
qui est une donnée très sensible à comparer au TTM des zones
saines (miroir) ; si cet allongement du TTM est associé à une
augmentation du VSC, il s’agit probablement d’une zone de
pénombre avec conservation d’une autorégulation. La Fig. 1
donne un exemple d’image acquise par cette technique.
2.2. Avantages et limites
La TDM de perfusion est accessible même en urgence et
peut s’intégrer dans le bilan lésionnel initial du patient fait avec
la TDM conventionnelle ; elle fournit des données régionales et
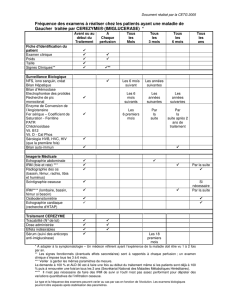
Tableau 1
Principales caractéristiques des techniques d’imagerie de la perfusion cérébrale [1]
TDM–perfusion TDM–Xénon IRM–Gadolinium IRM–MSA PET SPECT
Agent de contraste Iode Xénon stable Gadolinium Non
15
O
2
,C
15
O
2
,H
215
O
299m
Tc-HMPAO,
133
Xénon
Radiation ionisante 2–3 mSv 3,5–10 mSv Non Non 0,5–2 mSv 3,5–12 mSv
Durée examen
a
5–10 min 20 min 5–10 min 10–15 min 10–20 min 15–20 min
Intervalle entre 2 examens 10 min 20 min 25 min 0 min 10 min 10 min
Paramètres mesurés DSC, VSC TTM DSC DSC, VSC, TTM DSC DSC, VSC, EO
2
, glu DSC
Valeurs absolues Oui Oui Non Oui Oui Non
Influence gros vaisseaux Oui Non Oui Non Non Non
Variabilité 10–15 % 12 % 10–15 % 10 % 5 % 10 %
Résolution spatiale 1–2 mm 4 mm 2 mm 2 mm 4–6mm 4–6mm
Indications cliniques AVC AVC AVC AVC AVC AVC
Traumatisme Traumatisme Tumeurs Tumeurs Psychiatrie Traumatisme
Vasospasme Vasospasme Vasospasme Dégénératif Épilepsie Psychiatrie
Tumeurs Épilepsie Épilepsie Tumeurs Épilepsie
Fonctionnel Fonctionnel Fonctionnel
Disponibilité pour l'urgence Oui Oui Possible Possible Non Possible
VSC : volume sanguin cérébral ; DSC : débit sanguin cérébral ; EO
2
: extraction d’oxygène ; Glu : glucose ; TTM : temps de transit moyen ; MSA : marquage
des spins artériels ; mSv : millisievert.
a
La durée d’examen correspond à la somme du temps d’acquisition et du temps d’analyse.
J.-F. Payen et al. / Annales Françaises d’Anesthésie et de Réanimation 25 (2006) 722–728 723

absolues de perfusion cérébrale [2]. Ces propriétés sont des
atouts majeurs par rapport aux autres techniques. Dans de bon-
nes conditions d’acquisition et d’analyse, la TDM de perfusion
donne des résultats précis et fiables, validés par rapport à la
TDM-Xe et à l’IRM de perfusion [3,4]. Les résultats de la
TDM de perfusion sont disponibles en quelques minutes. Ce-
pendant, la variabilité de l’examen n’est pas négligeable (10–
15 %), et le champ anatomique exploré reste faible pour le
moment (une zone de 20 mm d’épaisseur avec un équipement
à quatre barrettes de détection, une zone de 80 mm avec un
équipement à 16 barrettes). Les gros vaisseaux et les pixels à
VSC élevés (supérieurs à 9 ml/100 g) influencent les calculs,
ce qui nécessite de les éliminer. En outre, cet examen nécessite
une injection d’iode et délivre une dose d’irradiation de l’ordre
de 2 mSv, ce qui reste du même ordre qu’en TDM convention-
nelle.
2.3. Applications cliniques
Les premières applications de la TDM de perfusion ont
concerné les patients ayant un accident vasculaire cérébral
(AVC) ischémique, susceptibles d’un traitement thromboly-
tique. La détermination des territoires ayant une ischémie ré-
versible (pénombre) et ceux ayant un infarctus massif avec
risque de transformation hémorragique doit être rapide et pré-
cise. Dans ce cadre, l’examen de référence est l’IRM de diffu-
sion, mais la TDM de perfusion s’est peu à peu imposée
comme une alternative précise et fiable [5]. Ainsi, le choix de
seuils pour le DSC (–34 % par rapport aux zones saines) et
pour le VSC (2,5 ml/100 g) a permis d’identifier les zones de
pénombre et les zones d’infarctus, avec des résultats très corré-
lés à ceux de l’IRM de perfusion–diffusion [6].D’autres études
ont montré que le TTM était aussi un paramètre sensible pour
apprécier la perfusion cérébrale, en prenant un seuil de six se-
condes [7].
Le vasospasme complique plus de 50 % des hémorragies
sous-arachnoïdiennes (HSA) par rupture d’anévrisme et s’ac-
compagne dans 20 à 40 % des cas d’une ischémie cérébrale
retardée. Chez dix patients ayant une HSA avec persistance
de troubles neurologiques après exclusion de l’anévrisme, la
TDM de perfusion a permis d’affiner le diagnostic en docu-
mentant selon les cas un vasospasme sans ischémie, une isché-
mie ou une hyperhémie [8].L’apport de cette technique par
rapport à l’artériographie conventionnelle, examen de référence
du vasospasme artériel, doit être évalué. Mais la possibilité de
répéter l’analyse à intervalles réguliers des mêmes régions d’in-
Fig. 1. Fenêtre de visualisation des quatre cartes de perfusion acquises par TDM de perfusion chez une patiente ayant eu une hémorragie sous-arachnoïdienne par
rupture d’anévrisme sylvien droit clippé, en phase vasospasme (j10). L’analyse de la perfusion montre une zone d’hypoperfusion dans le territoire sylvien droit
(flèche blanche) : diminution du débit sanguin cérébral (DSC) de plus de 50 %, allongement du temps de transit moyen (TTM) et du temps du pic maximal de
contraste (TTP), volume sanguin cérébral (VSC) peu modifié.
J.-F. Payen et al. / Annales Françaises d’Anesthésie et de Réanimation 25 (2006) 722–728724

térêts (ROI) devrait faciliter la stratégie thérapeutique : indica-
tion d’artériographie et de traitement endovasculaire, intensité
et durée du traitement médical.
En neurotraumatologie, la TDM de perfusion devrait avoir
un impact important. Ainsi, la présence de zones avec des fai-
bles valeurs de VSC dès l’admission a été un des facteurs in-
dépendants de mauvais pronostic à trois mois d’un traumatisme
crânien sévère [9]. Cet examen a permis de faire une évaluation
précoce du statut hémodynamique de 61 patients traumatisés
crâniens sévères, en distinguant ceux qui avaient une faible
relation entre pression de perfusion cérébrale et paramètres
TDM de perfusion (autorégulation probablement conservée)
et ceux qui avaient une relation étroite entre ces deux entités
(autorégulation probablement altérée) [10]. En somme, malgré
des imperfections, la TDM de perfusion devient un outil d’é-
valuation de la perfusion cérébrale, disponible précocement
pour les traumatisés crâniens et pour le suivi des patients ayant
une HSA.
2.4. TDM au xénon stable
La TDM de perfusion est à distinguer de la TDM au xénon
stable (xénon naturel). Celle-ci a été l’examen de référence
pendant plus de 20 ans pour estimer le DSC chez l’homme.
Après inhalation de xénon (28 à 30 % de fraction inspirée),
le DSC est calculé selon l’équation modifiée de Kety-Schmidt,
qui tient compte du coefficient de partition entre le sang et le
cerveau puisque le xénon stable est diffusible, et de la fonction
d’entrée artérielle estimée par la fraction expirée de xénon. Ce-
pendant, des effets indésirables (sédation, nausées), une grande
sensibilité aux mouvements du patient et une faible résolution
spatiale ont rendu cette technique de moins en moins utilisée.
Une étude récente a rapporté l’effet propre du xénon inhalé sur
le DSC (+12 %) chez des patients ventilés après TC ou HSA,
ainsi qu’une forte variabilité inter- et intra-individuelle (20 à
40 %) [11].
3. IRM de perfusion
3.1. Principes généraux
Comme la TDM de perfusion, l’IRM de perfusion repose
sur la détermination de la quantité d’un traceur sanguin qui
circule dans un volume de tissu donné, pendant un temps
donné en IRM, le signal est celui de l’eau [12]. Un agent de
contraste (gadolinium) peut être injecté pour modifier le signal
de l’eau (traceur exogène). Cette approche est aujourd’hui pri-
vilégiée en clinique. L’eau peut aussi être marquée magnéti-
quement (traceur endogène) ; c’est le marquage des spins arté-
riels (MSA).
La présence d’un agent de contraste paramagnétique dans le
compartiment vasculaire induit un gradient de susceptibilité
magnétique entre le compartiment vasculaire et le comparti-
ment tissulaire. Pour un voxel contenant un faible volume san-
guin (inférieur à 4 %), la variation du signal RMN est propor-
tionnelle à la concentration en agent de contraste. En injectant
le produit de contraste sous forme de bolus, et en analysant les
variations de signal RMN grâce à des techniques d’imagerie
rapide (séquences en écho de gradient), on peut calculer une
carte d’index de VSC. En mesurant la fonction d’entrée arté-
rielle, on peut obtenir une carte d’index de DSC. Mais l’obten-
tion de valeurs quantitatives du DSC est difficile du fait de la
relation complexe, non linéaire, entre le signal du sang et la
concentration en agent de contraste.
Le marquage des spins artériels (MSA) repose sur la détec-
tion d’eau endogène marquée magnétiquement. La modifica-
tion de l’aimantation de l’eau artérielle (inversion) induit une
réduction de quelques pour cent du signal RMN dans le tissu
analysé. Cette modification d’aimantation est directement liée
au DSC sur une cartographie en T
1
. De nombreuses manières
de réaliser l’expérience de marquage des spins artériels ont été
décrites [13]. Dans tous les cas, un volume de sang est marqué
avant d’irriguer le tissu d’intérêt, soit par un marquage pulsé
des spins artériels, soit par un marquage continu.
3.2. Avantages et limites
Après injection intraveineuse de gadolinium, l’analyse du
passage de l’embole est riche en informations, déjà décrites
avec la TDM de perfusion : TTM, TTP, VSC, index de DSC,
extravasation de la BHE. Mais ici, l’analyse est semi-quantita-
tive : des cartographies de ces paramètres permettent une com-
paraison entre des régions lésées et des régions saines. Cette
technique présente l’avantage de produire des données avec
un bon rapport signal sur bruit en un minimum de temps
(< 1 minute). Elle est possible sur tous les imageurs cliniques
de 1,5 Tesla, et présente l’avantage d’une association possible
avec d’autres méthodes IRM pour améliorer la performance
diagnostique : cartographies quantitatives T
1
et T
2
, imagerie
de diffusion, spectroscopie RMN. Cependant, les situations
de bas débit sanguin cérébral (DSC inférieur à 8 ml/100 g par
minute) et de rupture de la BHE (extravasation de l’agent de
contraste) ne permettent pas des mesures fiables du DSC.
En ce qui concerne le MSA, l’analyse repose sur des diffé-
rences faibles d’aimantation de l’eau entre avant et après mar-
quage, ce qui impose des images avec un excellent rapport si-
gnal sur bruit. La méthode est prise en défaut en cas de bas
débit (inférieur à 10 ml/100 g/min) et d’hyperhémie (supérieur
à 150 ml/100 g/min). Cependant, le MSA produit des cartes de
DSC sans être influencé par le signal des gros vaisseaux. L’ab-
sence d’injection intraveineuse rend cette approche acceptable
chez l’enfant, voire in utero, et permet de répéter sans délai les
mesures. Par ailleurs, la vitesse d’échange de l’eau au travers
de la BHE reste mal connue et pourrait influencer les mesures.
Une comparaison entre le MSA et le PET (H
215
O
2
) chez des
volontaires a donné une bonne concordance des mesures, prin-
cipalement dans la substance grise [14]. Cela étant, la princi-
pale limite des examens IRM réside dans l’accessibilité du pla-
teau technique et dans les contraintes liées aux champs
magnétiques de haute intensité.
J.-F. Payen et al. / Annales Françaises d’Anesthésie et de Réanimation 25 (2006) 722–728 725

3.3. Applications cliniques
Les domaines de prédilection de l’IRM de perfusion sont les
tumeurs et les accidents vasculaires cérébraux (AVC). La na-
ture des tumeurs (gliome de bas ou de haut grade), leur réponse
au traitement (récidive ou radionécrose), la distinction avec un
abcès cérébral sont des exemples qui font largement appel à
cette technique. Dans de nombreux centres, l’indication d’un
traitement thrombolytique en cas d’AVC ischémique repose
sur un examen par IRM de diffusion associé à une angiogra-
phie par IRM (angio-IRM) et/ou à une IRM de perfusion pour
préciser l’étendue de la zone à risque d’ischémie irréversible
[15].L’association des deux examens IRM (diffusion + perfu-
sion) a permis de préciser la nature exacte d’une détérioration
neurologique chez des patients de soins intensifs devant une
discordance entre les signes cliniques et la TDM convention-
nelle [16]. Grâce à cette approche combinée, l’étendue des lé-
sions ischémiques a été précisée chez des patients ayant un
vasospasme après HSA [17]. Pour le moment, aucune étude
clinique n’a été rapportée par IRM de perfusion après injection
de gadolinium chez des traumatisés crâniens. Pour le MSA,
moins utilisé en clinique, des travaux ont été conduits chez
des patients ayant eu un AVC ischémique, une tumeur, une
épilepsie, et en imagerie fonctionnelle grâce à la possibilité
de répéter facilement l’examen. Cette technique a permis de
quantifier les variations régionales du DSC chez le rat dans
un modèle de traumatisme crânien [18].
4. Tomographie d’émission de positons (PET)
4.1. Principes généraux
L’imagerie par PET repose sur l’administration de traceurs
exogènes radioactifs, marqués par des isotopes du carbone, de
l’oxygène ou du fluor, qui sont détectés par une caméra à po-
sitons. Selon l’isotope choisi, il est possible d’obtenir des in-
formations sur la perfusion cérébrale (
15
O) ou sur le métabo-
lisme du glucose (
18
F). Pour la mesure de la perfusion
cérébrale, le traceur peut être injecté en intraveineux (H
215
O)
et/ou inhalé (C
15
O
2
) pendant quelques minutes. Dans les deux
cas, il est nécessaire d’effectuer des prélèvements artériels de
manière simultanée pour connaître la fonction d’entrée arté-
rielle et permettre le calcul des paramètres cérébraux. Ainsi,
cette technique permet la détermination régionale et absolue
du DSC, du VSC, de la consommation cérébrale d’O
2
(CMRO
2
) et du coefficient d’extraction cérébrale en O
2
(EO
2
). Le métabolisme cérébral régional du glucose (CMRglu)
est déterminé après injection intraveineuse du
18
F-fluro-déso-
xyglucose (
18
F-FDG).
4.2. Avantages et limites
La demi-vie rapide des traceurs radioactifs (deux heures
pour
18
F, deux minutes pour
15
O) nécessite leur préparation
quasi-instantanée par un accélérateur de particules (cyclotron),
sur le site même de l’utilisation pour l’
15
O, ce qui constitue un
facteur limitant. L’irradiation corporelle après un examen PET
est d’environ 0,5 à 2 mSv, comparable à la TDM. La résolution
spatiale d’un examen PET (4–6 mm) est moins bonne qu’avec
l’IRM ou la TDM de perfusion ; il est souvent nécessaire de
projeter sur la cartographie en PET une image anatomique
(TDM, IRM). Néanmoins, il s’agit d’une technique dotée
d’une faible variabilité (5 %), permettant des résultats quanti-
tatifs, ne subissant aucune influence des conditions locales de
perfusion (gros vaisseaux, hypoperfusion).
4.3. Applications cliniques
L’essentiel des études menées en PET concerne des affec-
tions chroniques : évaluation préopératoire d’une sténose caro-
tidienne, tumeurs, épilepsie, démence, mouvements anormaux,
imagerie fonctionnelle. Dans le cadre de la recherche clinique,
la PET
15
O a été utilisée pour l’étude de la perfusion régionale
chez des traumatisés crâniens. Il a été ainsi montré que l’hy-
perventilation (PaCO
2
25–30 mmHg) pouvait réduire le DSC
sans altérer la consommation d’O
2
en raison d’une meilleure
extraction d’O
2
, y compris dans les zones les plus à risque
d’ischémie [19]. Plus récemment, les seuils admis pour entraî-
ner une ischémie cérébrale irréversible en pathologie neurovas-
culaire (DSC inférieur à 10 ml/100 g/min) ont été revus à la
hausse en pathologie traumatique (DSC 15 ml/100 g/min) [20].
La même équipe vient de montrer que l’augmentation de la
pression de perfusion cérébrale (de 70 à 90 mmHg) pouvait
augmenter le DSC et l’oxygénation cérébrale mesurée par la
pression intraparenchymateuse en O
2
(PtiO
2
) et diminuer en
conséquence l’EO
2
[21]. Cependant, l’examen par PET n’est
pas adapté à l’exploration en routine des patients en situation
d’agression cérébrale.
4.4. PET et SPECT
La PET est à distinguer de la tomographie d’émission mo-
nophotonique (SPECT), qui requiert l’injection intraveineuse
de traceurs (
99m
Tc-HMPAO,
133
Xenon) et une gamma-caméra
[22]. Son principal écueil réside dans sa faible résolution spa-
tiale liée à la dispersion des photons, sa variabilité non négli-
geable (10 %) et l’absence de quantification des mesures régio-
nales de DSC. La SPECT est surtout utilisée pour la
cartographie de récepteurs des neuromédiateurs. Quelques étu-
des ont été réalisées chez des traumatisés crâniens, ayant per-
mis notamment de suivre l’évolution temporelle du DSC dans
les suites d’un traumatisme crânien grave [23].
5. Imagerie métabolique par spectroscopie RMN (SRM)
5.1. Principes généraux
La SRM exploite le principe général de l’IRM (perturbation
d’une aimantation dans un champ magnétique) tout en tenant
compte de l’environnement électronique des espèces biochimi-
ques dans lesquelles se trouvent les noyaux de l’atome en ré-
sonance (spins). En effet, à chaque espèce biochimique corres-
J.-F. Payen et al. / Annales Françaises d’Anesthésie et de Réanimation 25 (2006) 722–728726
 6
6
 7
7
1
/
7
100%