Quantification de l`énergie des atomes

Seconde – Sciences Physiques et Chimiques Activité 3.3
1ère Partie : L’Univers – Chapitre 3 Correction
1
Quantification de l’énergie des atomes
En 1911, Ernest Rutherford propose une représentation simple de l’atome, en imaginant un
noyau autour duquel "gravitent" les électrons.
Ce modèle élégant, appelé aussi "modèle planétaire de l'atome", s'est révélé rapidement
insuffisant pour expliquer des résultats expérimentaux tels que les spectres atomiques
d’émission ou d’absorption de l’atome d’hydrogène, l’expérience de Franck et Hertz ou encore
l’effet photoélectrique. Nous allons rappeler ici les résultats qui découlent de l’analyse du
spectre atomique d’émission de l’atome d’hydrogène
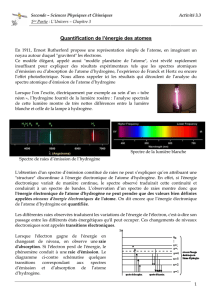
Lorsque l'on l’excite, électriquement par exemple au sein d’un « tube
néon », l’hydrogène fournit de la lumière rosâtre : l’analyse spectrale
de cette lumière montre de très nettes différences entre la lumière
blanche et celle de la lampe à hydrogène.
L'obtention d'un spectre d’émission constitué de raies ne peut s’expliquer qu’en attribuant une
"structure" discontinue à l'énergie électronique de l'atome d'hydrogène. En effet, si l'énergie
électronique variait de manière continue, le spectre observé traduirait cette continuité et
conduirait à un spectre de bandes. L’observation d’un spectre de raies montre donc que
l'énergie électronique de l'atome d'hydrogène ne peut prendre que des valeurs bien définies
appelées niveaux d'énergie électroniques de l'atome. On dit encore que l’énergie électronique
de l’atome d’hydrogène est quantifiée.
Les différentes raies observées traduisent les variations de l'énergie de l'électron, c'est-à-dire son
passage entre les différents états énergétiques qu'il peut occuper. Ces changements de niveaux
électroniques sont appelés transitions électroniques.
Lorsque l'électron gagne de l'énergie en
changeant de niveau, on observe une raie
d'absorption. Si l'électron perd de l'énergie, le
phénomène conduit à une raie d'émission. Le
diagramme ci-contre schématise quelques
transitions correspondant aux spectres
d’émission et d’absorption de l’atome
d’hydrogène.
Spectre de raies d’émission de l’hydrogène
Spectre de la lumière blanche

Seconde – Sciences Physiques et Chimiques Activité 3.3
1ère Partie : L’Univers – Chapitre 3 Correction
2
Les électrons sont donc répartis en couches d’énergie autour du noyau.
Ces couches sont plus ou moins proches du noyau ; la plus proche est nommé couche K (noyau
se dit Kern, en allemand) et les suivantes suivent l’ordre alphabétique.
Généralisation aux autres atomes
En réalité, tous les atomes présentent un spectre d’émission particulier, différant par la position
de leurs raies. Les atomes diffèrent les uns des autres par le nombre, l’énergie et surtout le
remplissage des couches d’énergie (ils ont des nombres d’électrons différents).
Règles de remplissage
A la manière des fans qui investissent une salle de spectacle, le premier rang se remplit, puis le
second, et ainsi de suite…
Le remplissage des couches est formalisé par la structure électronique de l’atome. Sur les couches,
le nombre d’électrons est limité : 2n² électrons maximum pour la couche de numéro n.
n = 1 n = 2 n = 3 n = 4
Nom de la
couche K L M N
Nb maximal
d’électrons 2 8 18 32
exemples de structures électroniques
Carbone
(C) Azote (N) Oxygène
(O) Fluor (F) Néon (Ne) Sodium (Na)
Z 6 7 8 9 10 11
Structure
électronique (K)2 (L)4(K)2 (L)5(K)2 (L)6(K)2 (L)7(K)2 (L)8(K)2 (L)4(M)1
Le rôle essentiel de la couche externe
La couche externe est la dernière couche dans laquelle des électrons sont répartis ; c’est donc la
couche qui délimite l’atome (expliquant d’ailleurs pourquoi certains atomes sont plus gros que
d’autres). Elle sert d’interface avec le monde extérieur et les autres atomes : de ce fait, elle
conditionne la façon dont l’atome va se comporter – et réagir – par rapport à l’environnement
extérieur… Tous les mécanismes chimiques s’expliquent en considérant les électrons de la
couche externe.
Spectre du mercure
1
/
2
100%