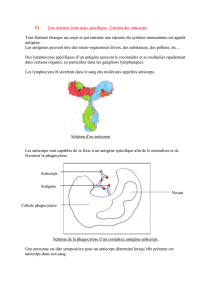
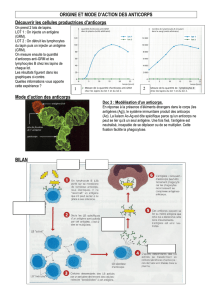
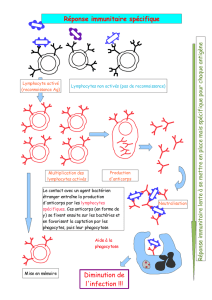
Usage des anticorps monoclonaux en thérapeutique

Lieu : Grande Salle des séances - Académie des sciences de l’Institut de France
Contact : Service des colloques, 23 quai Conti - 75006 Paris, tél : 01 44 41 43 82
Mardi 6 décembre 2005
Session de l’après-midi
Usage des anticorps monoclonaux en thérapeutique
Coordinateurs
Michel Bourel, de l’Académie nationale de médecine
Roger Monier, de l’Académie des sciences
14h Introduction, généralités
Michel Bourel, de l’Académie nationale de médecine
14h15 Anticorps monoclonaux : une longue saga technologique pour de nouveaux
médicaments
Jean-Luc Teillaud, Unité Inserm 255, Centre de recherches biomédicales des Cordeliers,
Université René Descartes, Paris V et Dominique Bourel, Laboratoire français des
biotechnologies, Les Ulis
Applications thérapeutiques
14h45 Anticorps monoclonaux dans le traitement de la polyarthrite rhumatoïde : vers une
révolution thérapeutique
Jacques Sany, Centre Hospitalier Universitaire de Montpellier
15h15 Proliférations hématopoïétiques :
Les anticorps monoclonaux dans le traitement des lymphomes malins
Bertrand Coiffier, Hospices Civils de Lyon et Université Claude Bernard, Lyon
Les anticorps monoclonaux dans le traitement de la leucémie lymphoïde chronique
Jacques-Louis Binet, Secrétaire perpétuel de l’Académie nationale de médecine
15h45 Pause
16h00 Principes de l’utilisation thérapeutique des anticorps monoclonaux en cancérologie
Hervé Fridman, Unité Inserm 255, Centre de recherches biomédicales des Cordeliers,
Université René Descartes, Paris V
16h30 Induction de la tolérance immunitaire par les anticorps monoclonaux : application aux
greffes d’organes et aux maladies auto-immunes
Jean-François Bach, de l’Académie des sciences
17h00 Conclusions
Roger Monier, de l’Académie des sciences
SEANCE COMMUNE
Académie des sciences – Académie nationale de médecine

Session de l’après-midi
Usage des anticorps monoclonaux en thérapeutique
Coordinateurs
Michel Bourel, de l’Académie nationale de médecine
Roger Monier, de l’Académie des sciences
INTRODUCTION
Michel BOUREL
Académie nationale de médecine
L’histoire des anticorps monoclonaux (ACM) donne l’image d’un cheminement ardu,
réfléchi et bénéfique.
Ardu, car il s’est écoulé près de trente ans depuis la découverte de leurs méthodes de
fabrication (Köhler et Milstein. 1975). Trente ans d’adaptations technologiques, d’abord pour parer
à l’immunogènicité des premiers anticorps murins, puis pour mettre au point des anticorps
humains en passant par les étapes d’anticorps chimériques puis humanisés.
Réfléchi car, à l’origine conçus comme des outils de recherche et de diagnostic, ils
connaissent depuis quelques années un développement croissant en tant que médicaments.
Bénéfique si l’on considère efficacité et tolérance à l’aulne des succès cliniques et de la
balance positive des avantages sur les quelques effets adverses, d’ailleurs variables en fonction
des molécules et des pathologies.
Aujourd’hui parmi la quelque vingtaine d’ACM mis sur le marché, quelques uns -
arbitrairement - ne seront ici qu’évoqués : ceux dédiés aux approches thérapeutiques des rejets en
transplantation d’organes, des pathologies de la coagulation, de certaines maladies infectieuses,
de maladies intestinales chroniques, de la maladie asthmatique, de la sclérose en plaques…
Par contre, vont être analysés :
- Les nouveaux enjeux technologiques pour ces médicaments émergents, par Jean-Luc
Teillaud et Dominique Bourel
- Leur place dans le traitement
de la polyarthrite rhumatoïde, par Jacques Sany,
des proliférations hématopoÏétiques, par Bertrand Coiffier
des leucémies lymphoïdes chroniques, par Jacques-Louis Binet
- Les principes de leur utilisation thérapeutique en cancérologie, par Hervé Fridman
- L’induction de la tolérance immunitaire (applications au diabète et aux greffes d’organes),
par Jean-François Bach.
La diversité de l’utilisation des ACM constitue, on le voit, un enjeu non seulement
thérapeutique, mais aussi technologique et économique.

ANTICORPS MONOCLONAUX :
UNE LONGUE SAGA TECHNOLOGIQUE POUR DE NOUVEAUX MÉDICAMENTS
Dominique BOUREL1 & Jean-Luc TEILLAUD2
1 Département Recherche, LFB, Les Ulis, 2 Unité INSERM 255, Paris
La mise au point de la technique d’obtention des anticorps monoclonaux (AcM) par
Georges Köhler et César Milstein, publiée en 1975 dans le journal Nature, fondée sur la fusion de
lymphocytes B « immuns » de souris avec des cellules de myélome et conduisant à la génération
de cellules hybrides B (hybridomes) productrices d’AcM a représenté un grand pas en avant pour
la biologie et la biologie clinique. Immédiatement après cette publication, des avancées
considérables furent obtenues dans le domaine de la recherche fondamentale et du diagnostic.
Cependant, d’importants problèmes surgirent lorsque l’utilisation des AcM chez des patients fut
envisagée. La question de l’obtention d’anticorps de haute affinité dirigés contre des cibles
spécifiques pertinentes se posa rapidement. Par ailleurs, l’utilisation récurrente d’AcM de souris
chez l’Homme montra qu’elle conduisait à l’apparition d’anticorps humains anti-anticorps de souris,
provoquant une diminution d’efficacité et des effets secondaires indésirables. De plus, les
propriétés effectrices des anticorps de souris injectés chez l’Homme [activation de la cascade du
complément et engagement des récepteurs Fc (RFc) conduisant à l’endocytose de complexes
immuns et à la cytotoxicité dépendante des anticorps] s’avérèrent être diminuées. De nombreux
travaux d’ingénierie cellulaire visant à résoudre ces problèmes furent alors entrepris :
transformation de lymphocytes B par le virus d’Epstein-Barr (EBV), utilisation de partenaires de
fusion optimisés, utilisation de stimuli divers (facteurs de croissance, anticorps …) pour obtenir une
immunisation in vitro et/ou une croissance à long terme de lymphocytes B humains normaux…
Malgré ces efforts, aucune technique d’ingénierie cellulaire fiable et facile d’emploi permettant
l’obtention d’AcM humains ne fut mise en place. Des efforts très importants ont été alors consentis
pour générer par ingénierie moléculaire des AcM ayant de meilleures affinités, une
immunogénicité réduite et de meilleures propriétés effectrices. Quatre stratégies d’ingénierie
moléculaire ont été mises en œuvre : i) construction d'anticorps chimériques comprenant parties
variables de souris et parties constantes humaines ; ii) construction d’anticorps humanisés par
greffe des régions hypervariables d'AcM de souris sur des régions charpentes humaines VH et
VL ; iii) construction de banques combinatoires de régions VH et VL humaines exprimées à la
surface de phages filamenteux ; iv) obtention de souris transgéniques contenant les gènes codant
chaînes lourdes et légères humaines.
Ces différentes approches ont permis la mise sur le marché de dix-huit AcM, dont certains
comme l’anticorps chimérique anti-CD20 rituximab ou les anticorps anti-TNFα ont conduit à des
avancées thérapeutiques significatives dans le domaine de l’oncologie et de l’inflammation. Cette
montée en puissance des AcM à usage thérapeutique est liée incontestablement aux stratégies
d’ingénierie d’anticorps résumées ci-dessus, mais également à notre meilleure compréhension des
mécanismes cellulaires et moléculaires de pathologies où une intervention thérapeutique à l’aide
d’anticorps peut être envisagée. D’autres approches d’utilisation d’AcM sont aujourd’hui
activement explorées. Par exemple, des fragments d’anticorps (anti-virus, anti-oncogènes) ont été
exprimés dans des cellules tumorales et dans des cellules infectées par des virus, pour bloquer ou
moduler les fonctions de protéines intracellulaires ("Intrabodies"). Par ailleurs, des études
intensives sur la stabilité et le repliement des anticorps recombinants, sur l’optimisation des
propriétés effectrices des régions Fc (par mutation ponctuelle et par modification du profil de
glycosylation), ainsi que sur la production en masse d’AcM par des plantes transgéniques ou dans
le lait d’animaux transgéniques sont actuellement développées. Tous ces anticorps de seconde
génération, dont on peut espérer qu’ils seront produits et utilisés à moindre coût, vont constituer
sans nul doute des outils majeurs pour mieux maîtriser des pathologies pour lesquelles peu ou pas
de solutions thérapeutiques existent à ce jour.

ANTICORPS MONOCLONAUX DANS LE TRAITEMENT DE LA POLYARTHRITE
RHUMATOÏDE : VERS UNE RÉVOLUTION THÉRAPEUTIQUE
Jacques SANY
Service d’Immuno-Rhumatologie
Avenue du Doyen Gaston Giraud-Hôpital Lapeyronie -CHU Montpellier
Les progrès de l’immunopathologie et de la biologie moléculaire ont permis depuis
quelques années le développement de certaines biothérapies. Parmi celles-ci, les anticorps
monoclonaux occupent une place de choix. Ils peuvent être dirigés soit contre les lymphocytes T
ou B, soit contre certains médiateurs solubles particulièrement importants comme le TNFα ou
l’interleukine 6.
Les anticorps monoclonaux anti-lymphocytes T ont été utilisés depuis 1988 sans résultats
décisifs mais avec un certain nombre de problèmes de tolérance. Le rôle des lymphocytes B dans
l’immunopathologie de la polyarthrite rhumatoïde (PR) semble avoir été totalement méconnu.
Pourtant un anticorps monoclonal anti-B CD20, le Rituximab (Mabthera®), donne dans certaines
formes de PR sévères d’excellents résultats. Ce produit peut induire des rémissions prolongées
supérieures à 6 mois avec parallèlement un effondrement du taux des lymphocytes B porteurs du
marqueur CD20 et une réduction du titre de facteur rhumatoïde. L’association Rituximab-
Méthotrexate est particulièrement efficace. On ignore pour l’instant si le Rituximab est susceptible
d’arrêter l’évolution radiographique de la PR. Les travaux sur ce sujet sont en cours de réalisation.
Les anticorps monoclonaux anti-TNFα constituent une avancée thérapeutique remarquable
dans le traitement moderne des PR sévères. On dispose actuellement de deux anticorps
monoclonaux anti-TNFα qui sont entrés dans le domaine de la pratique rhumatologique : d’une
part, l’Infliximab (anticorps monoclonal chimérique) commercialisé sous le nom de Remicade® et
d’autre part, un anticorps monoclonal totalement humain, l’Adalimumab commercialisé sous le
nom d’Humira®. Il est aussi possible de bloquer le TNFα en utilisant un récepteur soluble p75,
l’Etanercept commercialisé sous le nom d’Enbrel® mais il ne s’agit pas d’un anticorps monoclonal.
D’une manière générale, les agents modulant le TNFα ont prouvé dans le cadre d’études double
aveugle contre placebo en monothérapie et surtout en association avec le Méthotrexate une
remarquable efficacité clinique, biologique et radiographique dans environ 70% des cas au cours
de PR sévères et actives n’ayant pas répondu de manière adéquate au Méthotrexate. Le fait de
pouvoir arrêter l’évolution radiographique d’une PR est nouveau dans le domaine de la
rhumatologie inflammatoire. La question de l’utilisation précoce éventuelle de ces molécules est
posée car il est démontré qu’il est possible aujourd’hui d’éviter l’installation de lésions structurales
irréversibles grâce à ces molécules. Malheureusement, l’effet des anti-TNFα est suspensif, la PR
reprenant généralement son cours évolutif dans les semaines ou les mois qui suivent l’interruption
du traitement. Les effets indésirables sont dominés par le risque infectieux. Même si la fréquence
des infections est faible, ces dernières peuvent être graves et d’évolution défavorable, parfois
mortelle. On a décrit notamment de rares infections opportunistes et notamment des tuberculoses.
Ces dernières sont une fois sur deux non pulmonaires, volontiers atypiques, de diagnostic difficile
et d’évolution sévère. Il importe donc de dépister les patients à risque avant de mettre en route un
traitement par anti-TNFα (radiographie pulmonaire, intradermoréaction à la tuberculine). Il n’y a
pas, avec le recul dont on dispose (5 ans), d’induction démontrée d’affection néoplasique sous
anti-TNFα. Concernant les lymphomes, il est difficile de conclure car ils sont plus fréquents au
cours des PR sévères et anciennes qui constituent justement les indications des anti-TNFα. Une
auto-immunisation avec apparition d’anticorps antinucléaires et parfois anti-ADN natif n’est pas
exceptionnelle mais en règle générale elle n’a aucune conséquence clinique. D’exceptionnels cas
de lupus induit ont été rapportés dont l’évolution a toujours été très favorable.

Les anticorps monoclonaux anti-interleukine 6 correspondent à un anticorps humanisé
dirigé contre le récepteur de l’IL6 (MRA : Tocilizumab) ; il est en cours d’évaluation. Plusieurs
travaux concordants en double aveugle contre placebo donnent des résultats positifs à la
posologie de 8 mg/kg avec une tolérance correcte. Ce produit donne également des résultats
intéressants dans les formes systémiques de maladie de Still ce qui est particulièrement
intéressant car cette affection répond habituellement mal aux anti-TNFα.
Au total, le traitement des formes graves de PR a été transformé par l’avènement des anti-
TNFα. D’autres molécules notamment les anticorps monoclonaux anti-lymphocytes B donnent des
résultats extrêmement prometteurs. Néanmoins ces produits sont onéreux (surtout les anti-TNFα).
Il faut soigneusement analyser le rapport bénéfice-risque lors de toute prescription à cause du
risque infectieux.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%