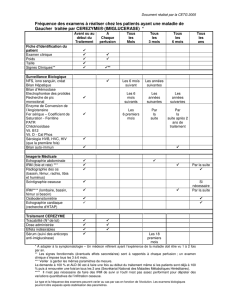
Le score dE GENEVE SIMPLIFIÉ EST

IRM MULTIPARAMÉTRIQUE DU CANCER DE LA PROSTATE
GLEASON 6 ET 7
J. Pucheux1,2, D. Bussy1,2, A.M. Bergemer-Fouquet1,3, P. Bertrand1,2, L.
Brunereau1,2
1 Faculté de Médecine – Université François Rabelais, Tours, France
2 Service de Radiologie – CHRU de Tours, France.
3 Service d’Anatomopathologie – CHRU de Tours, France

Introduction
Introduction Matériels et méthodes
Résultats Discussion Conclusion
Cancer de la prostate
- 1ère cause de cancer de l’homme
- 2ème cause de mortalité par cancer
Dépistage
- Toucher rectal
-Dosage sérique de l’antigène spécifique de
la prostate (PSA)
PSA > 4 ng/ml : cancer ?
Microbiopsie prostatique
G Fournier, A Valeri, P Mangin, O Cussenot. Cancer de la prostate. Diagnostic et bilan d’extension. Encyclopédie
médico-chirurgicale. 2004;(18-560-A-12)

Introduction Matériels et méthodes
Résultats Discussion Conclusion
Place de l’IRM
- Initialement bilan d’extension
-(R)évolution dans les indications de l’IRM prostatique
- Nouvelles techniques
- Amélioration des antennes
- Haut champ
- Séquences fonctionnelles
- Nouvelles exigences des cliniciens
- Diagnostic de plus en plus précoce, à un stade non palpable
- Traitement conservateur nécessitant une cartographie lésionnelle
L’IRM a désormais sa place dans la détection du cancer
Lemaitre L, Rouvière O, Penna-Renard R, Villers A, Puech P. MRI and prostate cancer: a paradigm shift. J Radiol. 2008
Sep;89(9 Pt 1):1053–64

Introduction Matériels et méthodes
Résultats Discussion Conclusion
Séquences fonctionnelles
Spectroscopie
Diffusion
Perfusion

Introduction Matériels et méthodes
Résultats Discussion Conclusion
Séquences fonctionnelles
Spectroscopie
Diffusion
Perfusion
Spectroscopie
Quantification de métabolites
Cancer prostate : Choline, Citrate
Se 72% - Sp 93%
Mais : Acquisition et post-traitement longs
Utilisation antenne endorectale
sfrnet.org
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
1
/
47
100%