1. Introduction

1
1. Introduction
éhll i
La chimie est la science des propriétés et
des transformations de la matière.
é
c
h
e
ll
e macroscop
i
que
échelle moléculaire
Quelle est la structure de la matière ?
•Demokrit (philosophe grecque 460-
371 AD) propose que la matière est constitué
des entités extraordinairement petites qu’il
L’idée est vieille:
•John Dalton (1766-1844):
dévelo
pp
e la
p
remière
appelait des atomes (dérivé du mot grecque
‘atomos’ = insécable)
La vérification expérimentale:
pp p
théorie atomique basé
sur les mesures
expérimentales

2
La structure de la matière
•aujourd’hui: l’existence des atomes est bien établie
•on peut observer des images d’atomes individuels p.ex. à
l’aide d’un microscope à balayage à l’effet tunnel (‘scanning
tunneling microscope (STM)’)
Image STM de la
surface de
GaAs
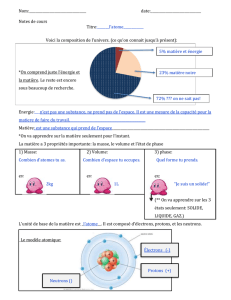
Toute matière est faite des atomes. Un élément chimique est
constitué d’un seul type d’atomes. Aujourd’hui ca. 112
atomes (éléments) différents sont connues.
Le programme du cours
toute matière est
composée de
particules
La particule qui est responsable pour les caractéristiques
chimiques est l’atome. Les atomes peuvent interagir est former
des groupes d’atomes fortement liés: les molécules.
Les interactions entre les molécules déterminent les points de
fusion et les points d’ébullition d’une composée.
La
g
lace l’eau va
p
eur d’eau
gp
solide moléculaire liquide moléculaire gaz moléculaire

3
2. La structure des atomes
2. La structure des atomes
•• La structure interne des atomes: La structure interne des atomes:
les particules subatomiquesles particules subatomiques
•• La structure interne des atomes: La structure interne des atomes:
les particules subatomiquesles particules subatomiques
•
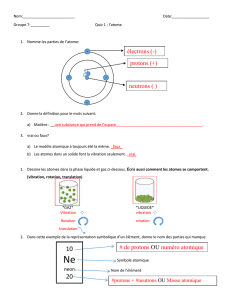
Les atomes ne sont pas les plus petits particules possible
Les
atomes
ne
sont
pas
les
plus
petits
particules
possible
mais ils sont constitués de particules subatomiques:
les électrons, protons, et neutronsles électrons, protons, et neutrons

4
Le modèle de Rutherford
→ l’atome contient un noyau très petit où toute la masse et la
charge positive (les neutrons et les protons) sont concentrée
entourée par un grand nuage électronique.
Le nuage électronique et le noyau
Exemple: rnuc = 1 cm
x
Le rayon électronique
est beaucoup plus grand
que le rayon du noyau:
rel = 1km
rel/rnuc ≅104-105
x

5
La structure du noyau
La chimie:
-changements dans le
nuage électronique
-forces
électromagnétique
Protons et
neutrons sont
constitués de
particules
encore
p
lus
électromagnétique
-énergie d’interaction
typique: 400 kJ/mol
La structure du noyau
p
élémentaires:
les quarks
La structure du noyau: la physique nucléaire
Jusqu’à 1932:
3 particules élémentaires: les électrons, protons, et les
neutrons
Aj d’hi
> 100 ti l élé t i ( i it
A
u
j
our
d’h
u
i
:
>
100
par
ti
cu
l
es
élé
men
t
a
i
res
(
p
i
ons, pos
it
ons,
anti-particules,neutrinos, quarks (6 saveurs: up, down,
charm, strange, top, bottom, 3 couleurs and
3 anti-couleurs)
Site web des particules élémentaires:
Quelles sont les forces qui tiennent le noyau ensemble
malgré la large répulsion entre les protons?
http://sol.sci.uop.edu/~jfalward/elementaryparticles/elementaryparticles.h
tml
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%