LA SOLUBILITE Nous avons vu que les solutions sont des

Chimie 1ère - 2008/2009 - Cours et exercices -29-
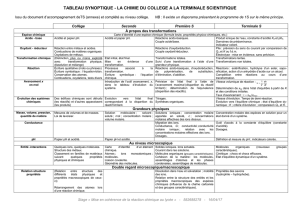
LA SOLUBILITE
Nous avons vu que les solutions sont des mélanges homogènes. Les plus connues sont les
solutions aqueuses, dans lesquelles le solvant est l'eau.
Un mélange de sel de cuisine (soluté) et d'eau (solvant) en est un exemple.
Dans le cours d'IDS vous avez effectué des expériences permettant de déterminer de façon
quantitative la solubilité de deux substances dans l'eau. Rappelons la définition de la solubilité
que vous avez alors formulée :
La solubilité d’un soluté dans un solvant donné est définie par la quantité maximale de
ce soluté qui peut se dissoudre dans un volume donné de solution.
Elle est généralement exprimée en gramme de soluté par litre de solution.
Plusieurs facteurs influencent la solubilité :
• La structure, c’est elle qui détermine la polarité des molécules de la substance.
• La pression dans le cas des gaz, son augmentation accroît la solubilité des gaz.
• La température, son élévation augmente (mais pas toujours) la solubilité des solides,
mais diminue la solubilité des gaz.
D’une manière générale on retiendra encore que :
• Les substances polaires sont solubles dans les solvants polaires
• Les substances non polaires sont solubles dans les solvants non polaires
On voit sur ce schéma que la mise en solution d'un soluté est en fait la dispersion des
particules qui la constituent dans le solvant. Cette représentation sera détaillée dans les pages
suivantes.

Chimie 1ère - 2008/2009 - Cours et exercices -30-
On veillera à utiliser un vocabulaire précis et à ne pas dire que le sel "a fondu" et qu'il est
"liquide", mais qu'il s'est dissous et qu'il est en solution aqueuse.
A COMPLETER :
Une substance dissoute est appelée . . . . . . . . . . .
Le liquide qui permet sa dissolution est appelé . . . . . . . . . . .
Soluté et solvant constituent . . . . . . . . . . qui est un mélange . . . . . . . . . . . .
Parmi les substances solubles dans l'eau, il en est deux que nous rencontrons chaque jour: le
sucre et le sel de cuisine. Du point de vue chimique, ces substances se dissolvent dans l'eau de
deux manières différentes:
- Cas des composés moléculaires.
Un grain de sucre (glucose) est un petit cristal constitué de molécules (de formule
C6H12O6) dont toutes les liaisons internes sont covalentes. Lorsque ce grain de sucre est
dissous dans de l'eau, chaque molécule C6H12O6 se retrouve entourée de molécules d'eau,
et isolée des autres molécules de sucre. Les liaisons covalentes ne sont pas rompues;
chaque molécule reste entière.
- Cas des composés ioniques.
Un grain de sel de cuisine (chlorure de sodium, formule NaCl) est un petit cristal constitué
d'ions Na+ et Cl-, liés par des liaisons ioniques. Lorsque ce grain de sel est dissous dans de
l'eau, les liaisons ioniques sont rompues et les ions se retrouvent isolément dans la
solution, chacun étant entouré de molécules d'eau (on dit que l'ion est hydraté).
Représentation schématique de ions hydratés:
Les composés organiques sont constitués essentiellement d'atomes de carbone et d'hydrogène.
Les atomes de carbones y sont liés entre eux et forment le squelette de ces composés. Les
molécules organiques peuvent également contenir d'autres atomes, principalement ceux
d'oxygène et d'azote. Toutes les liaisons dans ces composés sont covalentes.
La plupart de ces composés organiques (ex: alcool, acétone) se comportent comme le sucre:
leurs molécules restent entières lors de la dissolution dans l'eau.

Chimie 1ère - 2008/2009 - Cours et exercices -31-
Les composés minéraux solubles se comportent comme NaCl : ils se dissocient en ions. Du
fait des charges électriques positives et négatives portées par le soluté, la solution obtenue
conduit l'électricité. Pour cette raison, on appelle aussi les composés minéraux solubles des
électrolytes.
Remarques:
1) Pour qu'un solide soit soluble dans l'eau, il faut que l'attraction entre les ions (ou les
molécules) qui le constituent et les molécules d'eau soit plus forte que les forces qui lient
ces ions (ou molécules) à l'intérieur du solide.
2) Tous les composés ioniques ne se dissolvent pas dans l'eau! Ni les dioxydes de silicium
(SiO2), constituants principaux du granite (roche la plus répandue), ni les oxydes
d'aluminium (Al2O3) formant, par exemple, le rubis, ne sont solubles dans l'eau.
EXERCICE :
1) La solubilité du chlorure de calcium (CaCl2) dans l’eau à 20 [°C] est de 745 [g] par litre.
a) Dessinez un croquis de ce que l’on pourrait observer à l’échelle moléculaire dans une
telle solution.
Echelle macroscopique Echelle moléculaire
b) Quelle masse maximale de chlorure de calcium peut-on dissoudre dans 25 [mL] d’eau ?

Chimie 1ère - 2008/2009 - Cours et exercices -32-
INTRODUCTION A LA REACTION CHIMIQUE
... où l’on apprend notamment à équilibrer
une équation chimique.
Dans le cours on a mentionné (p. 7) que l'électrolyse de l’eau, un corps composé, donne deux
corps simples, l’oxygène et l’hydrogène.
De plus vous venez de voir que lorsqu'il se dissout, le sel de cuisine (NaCl) se dissocie en ses
ions Na+ et Cl-.
Il s'agit d'exemples de réactions chimiques.
Une réaction chimique est transcrite sous forme d’une équation chimique qui présente les
réactifs dans le terme de gauche et les produits dans le terme de droite. La flèche les
séparant est le symbole montrant un processus de transformation.
Exemple: réaction de dissociation du chlorure de sodium:
Au cours d’une réaction chimique, il n’y a ni perte ni gain de matière ni
transformation de la nature des atomes. Ce principe a été énoncé par Lavoisier et
peut se résumer par : « Rien ne se perd, rien ne se crée ».
Si "rien ne se perd, rien ne se crée" au cours d'une réaction, quels sont alors les changements
qui s'y produisent ?
EXERCICES :
Equilibrez les réactions chimiques suivantes :
1) Fe + O2 → Fe2O3
2) BaCl2 + H2SO4 → BaSO4 + HCl
3) C + SO2 → CS2 + CO
4) NiCl2 + KOH → Ni(OH)2 + KCl
5) CH3OH + O2 → CO2 + H2O
6) HNO3 + Be(OH)2 → Be(NO3)2 + H2O
Identifiez les réactions impliquant un échange d’ions et celles qui nécessitent de briser toutes
les liaisons.
Réactions et états physiques
Pour compléter l’information contenue dans une équation chimique, on peut écrire sous les
réactifs et les produits l’état physique dans lequel ils se trouvent.
a) CaCO3 + HCl → CaCl2 + CO2 + H2O
b) Ba(OH)2 + CO2 → BaCO3 + H2O

Chimie 1ère - 2008/2009 - Cours et exercices -33-
Réactions et échanges d'énergie
L’équation chimique n’indique pas toutes les informations concernant une réaction. Elle
n'indique pas les échanges d'énergie qui, au cours de la réaction, ont toujours lieu entre le
système chimique et son environnement.
Mais d'où provient cette énergie échangée ?
Pour briser les liaisons entre les atomes, il faut fournir de l’énergie. Mais lorsque les produits
se forment, de nouvelles liaisons chimiques s'établissent, ce qui libère de l’énergie.
Une réaction qui libère de la chaleur est appelée une réaction exothermique. L’énergie
libérée lors de la formation des liaisons dans les produits est alors plus importante que celle
absorbée pour casser les liaisons dans les réactifs.
C'est le cas notamment dans toutes les réactions de combustion.
Dans le cas contraire, la réaction est appelée endothermique. (Exemple: dissolution du
NH4NO3)
Ces transferts d'énergie peuvent également avoir lieu sous forme d’énergie électrique,
d’énergie lumineuse ou mécanique.
LES REACTIONS IONIQUES
Réactions de dissociation
Nous venons de voir qu'une réaction chimique peut être représentée par une équation. D'autre
part, nous avons vu que les substances minérales solubles se dissociaient.
On peut représenter une dissociation par une équation chimique
exemple: la dissociation du NaCl se note :
NaCl → Na+ + Cl-
Exercice 1
En vous aidant du tableau des ions qui se trouve à la page 39, écrivez l'équation de
dissociation dans l'eau des composés suivants:
a) KBr
b) MgCl2
c) NaOH
d) Na2SO4
e) K3PO4
f) Ca3(PO4)2
Pour les points b) et c), représentez à l'échelle moléculaire, comme dans l'exercice 1 de la
page 34, la solution obtenue après dissociation des composés.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%