potentiel de repos_2014

J. Teulon, LV 207 AHA, UPMC, 2014
1
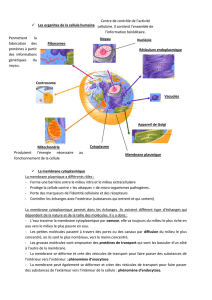
Potentiel de repos
1.Système de transport ionique; conditions ioniques
dans la cellule ; origine du potentiel de membrane.
2. Équation du potentiel de membrane dérivée à partir
de la notion de circuit équivalent
3.Aperçu sur les équations de Goldman-Hodgkin-Katz
Systèmes de transport ionique
Na+K+
K+
Na
+
H
+
Na
H
•Transports actifs : consomment de l’énergie métabolique (ATP) et
maintiennent une différence de concentration entre cellule et milieu
extracellulaire pour un ou plusieurs ions.
Pompes Na+/K+, Ca2+, H+, K+/H+...
•Transports secondairement actifs : utilisent le gradient chimique ou
é
’
é
lectrochimique d
’
un ion pour transporter un autre ion.
Echanges : Na+/H+, Cl-/HCO3-...
Cotransports : K+-Cl-, Na+-K+-2Cl-...
•Transports passifs (perméabilités) : dissipent le gradient électrochimique.
Canaux ioniques K+, Na+, Ca2+, Cl-...
Transports facilités (uniports) glucose, phosphate, etc…

J. Teulon, LV 207 AHA, UPMC, 2014
2
Conditions ioniques et potentiel de membrane
Un dispositif (pompes)
est nécessaire pour
maintenir le système à
l’état stationnaire
Na+145
mM
10
mM
Na+
-
+-
+-+
-+
-+
-+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
Na+
K+
K+
Cl-
5
120
HCO3-24
140
11
K+
Cl-
HCO3-15
Protéines Z-
-
+-
+-
+-
+
-+
-+
-+
-+
------------
-
+-
+-70 mV
• Électroneutralité de la cellule
• Séparation de charges de chaque côté de la membrane dans son
voisinage (la membrane se comporte comme un condensateur).
• le potentiel de membrane est dû à la diffusion ionique à travers la
membrane.
+
+
+
+
+
+
+
+
+
+
+
+
Deux approches :
• Circuit électrique équivalent
• Équations de Goldman-Hodgkin-Katz (plus
proches du phénomène physique)

J. Teulon, LV 207 AHA, UPMC, 2014
3
Potentiel d’équilibre pour un ion, ici le potassium
(potentiel de Nernst)
• Seul le potassium est perméable à travers la membrane séparant les deux milieux
• On « ouvre » la membrane à l’instant zéro
•A l’équilibre, une ddp trans-membranaire s’oppose au mouvement de K
V = Ex= -83 mV
V = 0
K+K+
C
K+K+
+
+
+
-
-
-
[KCl] = 135 [KCl] = 5
C
l-Cl-
[KCl] = 135 [KCl] = 5
•Il y a séparation de charges électriques uniquement à travers la
membrane plasmique.
E
RT/ZF Ln([X
]/[X
])
Le potentiel d’équilibre pour un ion
(potentiel de Nernst)
à travers une membrane s’écrit :
E
x =
RT/ZF
Ln([X
e
]/[X
i
])
Ex= 58 Log [Xe]
[
X
i
]
pour un cation monovalent pour un anion monovalent
Ex= 58 Log [Xi]
[
X
e
]
R: constante des gaz parfaits (8314 J/mol/°K)
T: température absolue (°C + 273)
Z: valence
F: Faraday (quantité d’électricité représentée par 1 ion gramme,
soit 96500 coulombs)
Ln = log népérien, Log = log décimal
[
i
]
[
e
]

J. Teulon, LV 207 AHA, UPMC, 2014
4
Prenons une membrane perméable au sodium et
au potassium
• chlorure imperméant
• sodium et potassium perméants
V = ? ENa 65
K+K+
Na+Na+
0
Em???
[KCl] = 135 [KCl] = 5
[NaCl] = 10 [NaCl] = 140
A quelle valeur se stabilise la ddp
transmembranaire ?
EK-83
(mV)
Cela dépend …. des conductances
sodium et potassium
Flux ionique à travers une conductance (transport passif)
e
Ex
rx
i
i
V = Vi-V
eV
V = Ex+rxixsoit : i = (V-Ex)/rx
•Analogie avec les circuits électriques (un circuit indépendant pour chaque ion)
• La différence de concentration ionique de part et d’autre de la membrane
constitue une sorte de pile ayant une fem de valeur Ex pour l’ion X.
Gradient électrochimique
ou encore : ix= gx*(V-Ex)
On a l’habitude dire qu’il s’agit d’une transposition de la loi d’ohm

J. Teulon, LV 207 AHA, UPMC, 2014
5
Circuit équivalent pour une cellule non épithéliale
Na
+
145
mM
10
mM
Na
+
EK
rK
Na
K+
Cl-
145
5
110
10
140
11
Na
K+
Cl-ECl
ENa
r
Na
rCl
Na+
K+
ENa= 58 log(145/14) = 60 mV
EK= 58 log(5/140) = -84 mV
ECl= -58 log(110/11) = -58 mV
Potentiel de membrane à l’équilibre
I
(
V
E
)
ix= gx*(V-Ex)Na+
K+
EK
rK
E
r
N
I
Na = gNa
(
V
m
–
E
Na
)
IK= gK(Vm–E
K)
ICl = gCl (Vm–E
Cl)
I = Σgx(Vm–E
x)
A l’équilibre
-70 mV
ECl
E
Na
r
N
a
rCl
I = INa + IK+ ICl = 0, gNaENa + gKEK+ gClECl
Em= gNa + gK+ gCl
VmΣgx= ΣgxExΣgxEx
Vm=Σgx
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%