Mécanismes de réponse cellulaire aux dommages dans l`ADN et

Cancérologie
Binome 2
Cours du vendredi 16/09/11 de 16h à 18h
Mécanismes de réponse cellulaire aux dommages dans
l’ADN et maladies génétiques associées
N.B : Voici des abréviations souvent utilisées :
- sb : simple brin
- db : double brin
- ADN pol : ADN polymérase
Importance des systèmes de réparation :
L’ADN est la seule molécule biologique réparée et non remplacée.
Plus de 100 gènes sont impliqués dans les mécanismes de réparation.
Si une lésion est mal ou non réparée alors se produit une mutagénèse et donc une non
fonctionnalité d’un gène (ce qui peut conduire à un cancer).
Si des dommages sont présents dans l’ADN alors ils doivent être réparés pour assurer
une stabilité génomique. Cela peut induire des pathologies dont les cancers et aussi une
divergence génétique.
Il existe différentes isoformes des protéines de réparation.
La recombinaison entraine des diversités protéiques.
Il existe différents systèmes de réparation qui prennent en charge différents types de
lésions :
- réparation directe (par réversion) : une seule enzyme intervient
- réparation par excision de la région endommagée : BER (répare base)/ SSBR
(pour cassures sb), NER (répare nucléotide), mismatch repair : réparation des
mésappariements (erreurs des ADN pol lors de la réplication)
- réparation des coupures db : HR (recombinaison homologue car elle utilise 2
brins homologues) et NHEJ (recombinaison non homologue)
- passage de lésion (réparation translésionnelle)
I/ Réparation directe
Une seule étape
2 systèmes connus
1. MGMT (méthyltransférase)
Mécanisme suicidaire : une seule enzyme répare les lésions de type O6 méthylguanine
(lésions dues aux radicaux libres et à la fumée de cigarette).
L’enzyme greffe le méthyle sur une de ses cystéines, est dirigée vers la dégradation et
cela répare la lésion de l’ADN.
Dans certains polypes colorectaux et glioblastomes, il y a des altérations de la MGMT
(hyperméthylation du promoteur du gène) et donc accumulation des lésions.

2. Photoréactivation
Il existe chez les eucaryotes inférieurs mais n’est pas encore identifié chez les
mammifères placentaires.
Photolyase : enzyme qui répare les lésions induites par les UV (dimères de thymine) qui
sont des lésions encombrantes pour l’ADN.
La CPD-photolyase reconnaît ce type de dommage et utilise l’énergie apportée par la
lumière pour s’activer et réparer la lésion.
II/ Réparations plus complexes (par excision de la région
endommagée)
BER : Répare les dommages induits par les radiations ionisantes, les alkylations et les
réactions spontanées du métabolisme cellulaire
NER : en réponse à des lésions beaucoup plus encombrantes (UV ou dommages produits
par les fumées de cigarette)
HR et NHEJ : répare les cassures db dues aux anti-tumoraux et aux UV
Mismatch repair: répare les erreurs de la réplication
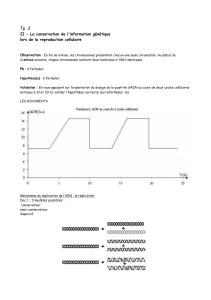
Après les dommages, la cellule se fige pour la réparation (il n’y a plus de réplications, de
transcriptions et arrêt du cycle cellulaire sinon se produisent plein de mutations).
1. BER et SSBR
Lésions réparées par le BER :
- désintégration spontanée de liaisons chimiques dans l’ADN
- sous produits du métabolisme cellulaire normal
- agents environnementaux
a. Désintégration spontanée de liaisons chimiques dans l’ADN
- Hydrolyse de nucléotides générant des sites abasiques non instructifs : plusieurs
milliers de dépurinations et centaines de dépyrimidinations
- Désaminations spontanées (ex : cytosines -> uraciles)
b. Sous produits du métabolisme cellulaire
- oxydations par des espèces réactives oxygénées (ROS) qui dérivent de la
respiration oxydative et de la peroxydation des lipides
- méthylations : production de 3-méthyladénine par la S-adénosylméthionine
c. Agents environnementaux
- UVA et UVB et dommages oxydatifs induits par les UVB

- Radiations ionisantes
- Agents chimiques
Conclusion : ce système prend en charge les méthylations de bases, les sites
abasiques et cassures sb
Etapes du BER :
- reconnaissance des lésions :
pour BER :ADN glycosylases
et pour SSBR : poly (ADP-ribose)polymérase (PARP)
- élimination de la base endommagée :
ADN glycosylases ou ADN glycosylases-AP lyases (capables de créer une incison
en 3’ ou 5’ de la lésion)
- incision du squelette sucre-phosphate
APE : AP endonucléases, incision en 3’ du site abasique
ADN glycosylases-AP lyases, incision en 5’ du site abasique
- élimination du nucléotide abasique
- polymérisation de novo
ADN polymérases
- ligation
ADN ligases
En réalité c’est plus compliqué car il y a de nombreux intervenants et plusieurs sous
voies :
- BER : short patch repair SPR : brèche de 1 à 2 nucléotide
- SSBR : long patch repair LPR : brèche d’environ 6 nucléotides : d’autres ADN pol
plus processives interviennent
La voie est choisie en fonction du type de dommage, de l’enzyme qui reconnaît la lésion
et du cycle cellulaire.
Rôle de la réaction de poly(ADP-ribosyl)ation dans la réponse cellulaire aux
interruptions de l’ADN :
Important : PARP est une enzyme qui catalyse une réaction de poly ADP ribosilation
après avoir reconnu la cassure sb (modification post traductionnelle des protéines).
En réponse aux cassures sb, ces protéines PARP utilisent le NAD et catalyse la synthèse
d’ADP-ribose sur des protéines nucléaires qui jouent un rôle dans la réponse cellulaire
aux dommages.
En inhibant PAR avec des inhibiteurs PARP on empêche la SSBR donc accumulation des
cassures sb qui se transforment en cassures db par réplication et elles ne peuvent plus être
réparées ce qui entraine la mort cellulaire (donc utilisé dans la thérapie du cancer).

En cas d’ischémie, il y a une accumulation de cassures dans l’ADN donc PARP est suractivée
(puisqu’elle reconnaît ces cassures) ce qui cause une production excessive de polyADP-
riboses entrainant la mort cellulaire. Ainsi les inhibiteurs PARP ont aussi un effet bénéfique
pour protéger de la mort cellulaire.
Il existe des anticorps dirigés contre le poly ADP ribose. On peut donc aujourd’hui doser
cette activité de poly ADP ribosilation et ainsi reconnaitre les cellules endommagées, ce
qui permet de doser la thérapie anti cancer.
La synthèse de poly ADP ribose a 2 fonctions :
- recruter des enzymes de réparation sur le site de cassure (ex : XRCC1 a des
domaines de liaisons au poly ADP-ribose, sinon XRCC1 ne vient pas sur le site de
cassure)
- moduler l’activité des protéines de réparation
BER et cancer :
Il y a très peu d’évidences qu’une mutation dans une protéine de ce système de
réparation ne conduise au cancer.
On a quand même pu reconnaître des mutations dans certaines ADN glycosylases (ex :
OGG1 : qui répare les 8-oxoguanines, générées par la fumée de cigarette) mais pas
systématiquement (études toujours en cours). Cela est surtout retrouvé chez les patients
âgés donc est peut-être lié au vieillissement.
Les fumeurs âgés qui présentent un problème de réparation de la 8-oxoguanine (OGG1
muté) développent un cancer du poumon.
SSB : cassures sb
Sous processus de ce système de BER/SSBR
Cela induit des pathologies neurologiques.
Il y a 10 a 10000 cassures sb/jour/cellule qui viennent des dérivés radicalaires de
l’oxygène (attaque oxydative par les ROS), des désintégration des sucres, des produits
du BER ou des erreurs de la topoisomérase I.
Les cassures sb bloquent la réplication, inhibent la transcription et induisent une
suractivation de la PARP et donc la mort cellulaire.
En fonction des dommages il n’y a pas les mêmes systèmes de réparation qui sont
induits.
Important : 2 protéines sont à connaitre pour la réparation de ces cassures sb : APTX et
TDP1.
Chez les patients traités à la camptotécine, ce médicament inhibe la topo I ce qui
provoque une accumulation des cassures sb.
TDP1 permet le relarguage de la topo I qui sinon reste bloquée.
PARP, XRCC1 et PNK (polynucléotide kinase qui reforme les extrémités 5’P et 3’OH) sont
recrutés puis il y a ligation.

2. NER
Ce système répare les lésions induites par les UV (qui contorsionnent et distorsionnent
l’ADN) : dimères de pyrimidines (CPD) et les 6-4 photoproduits (PP).
2 sous voies de réparation :
- globale sur tout le génome (GG-NER)
- ou associée à la transcription (répare les lésions UV pendant la transcription) :
lésions qui bloquent l’ARN pol II donc d’autres protéines vont réparer (TC-NER)
a. GG-NER : global-genome NER
Répare les lésions de type CPD ou 6-4PP.
- Reconnaissance de la lésion par une protéine XPCR23 (existe 7 XP : XPA, B, C, D,
E, F, G). Une mutation d’une XP induit le xeroderma pigmentosum.
- Formation puis fixation d’un gros complexe protéique autour de la lésion qui
ouvre la double hélice de l’ADN. Dans le complexe se trouvent TFIIH, ADN pol II,
XPA, XPG et RPA.
- Excision du brin d’ADN contenant la lésion (XPF coupe en 5’ de la lésion et XPG
coupe en 3’) donc on enlève une brèche d’environ 1000 nucléotides.
- Polymérisation : les polymérases processives polymérisent la brèche.
- Ligation
b. TC-NER : transcription-coupled NER
CSA et CSB (mutation -> cockayne syndrome) : rôle d’hélicase
BRCA1 et BRCA2 (mutations -> cancer sein et ovaire)
Maladies génétiques associées au NER :
Xeroderma pigmentosum (enfants de la lune) : mutation dans un gène XP entrainant des
problèmes de réparation de ces lésions et facilement des cancers si les patients
s’exposent aux UV.
Aujourd’hui 7 protéines XP induisent Xeroderma Pigmentosum + un variant XPV qui a
un rôle dans NER mais dont la mutation n’entraîne pas de sensibilité aux UV
Cockayne syndrome (CS) : mutation dans CSA ou CSB
Sensibilité aux UV si aussi mutation aux gènes XP
Ce syndrome entraine un vieillissement accéléré, une dégénérescence neuronale
accentuée, un nanisme, des anomalies faciales et des déficiences neurologiques.
Trichothiodystrophie (TTD) : XPB ou XPD muté
Anomalies faciales, vieillissement accéléré et surtout cheveux cassants
Pathologie moins délétère (effets entre XP et CS)
 6
6
 7
7
 8
8
 9
9
1
/
9
100%