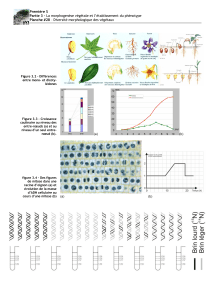
Duplication du centrosome

!
1!
LA DIVISION CELLULAIRE
La phase M de la division cellulaire comporte deux événements : la division du noyau, ou
mitose, et la division cytoplasme, ou cytodiérèse. Au cours de cette division, les différents
composants d’une cellule parentale (qui ont doublé au cours de l’interphase précédente)
sont partagés entre les deux cellules filles.
I. Duplication du centrosome
La duplication cellulaire nécessite la duplication du centrosome (figure 1). Le centrosome,
ou centre cellulaire, est le centre organisateur de microtubules de la cellule. Il est constitué
d’une matrice protéique associée à une paire de centrioles (un centriole est une structure
cylindrique constituée de 9 triplets de microtubules). A la fin de la phase G1 (voir le début du
chapitre sur le noyau), les 2 centrioles se séparent de quelques microns mais restent reliés
entre eux. Au cours de la phase S, un centriole fille apparaît à la base de chaque centriole
mère, et s’allonge à angle droit. Deux centrosomes se forment : l’un contient le centriole le
plus ancien (marqué par la présence d’appendices distaux sur le centriole – disque gris a la
base du centriole sur la figure 1 - et la présence de tubuline epsilon dans le matériel
péricentriolaire), l’autre est encore immature. L’élongation des centrioles filles et la
maturation du deuxième centrosome continuent pendant la phase G2. Les deux
centrosomes restent appariés jusqu’au bout de la Phase M. Les centrosomes s’éloignent
ensuite pour donner deux faisceaux de microtubules irradiant en étoile autour de chaque
centrosome, appelés alors asters. Ces deux asters vont former les pôles du fuseau
mitotique.
Figure 1 : Cycle du centrosome (réplication de centrioles) (voir le texte pour explications)

!
2!
II. Description morphologique
La description de la division cellulaire est basée sur l’observation microscopique de cellules
en phase M. La division nucléaire comporte 5 étapes successives survenant dans un ordre
précis, alors que la cytodiérèse commence pendant la division nucléaire et se termine à la fin
de la phase M (figure 2).
Figure 2 : Durée des différentes étapes de la mitose et position de la cytodiérèse
1- La prophase (figure 3.1)
Le début de la prophase est défini comme le moment ou la condensation chromatinienne,
ayant débuté au cours de la phase G2, permet la visualisation de différents chromosomes.
Ces chromosomes ayant dupliqué leur ADN au cours de la phase S précédente, se
présentent sous la forme de deux chromatides sœurs, associées sur toute leur longueur. Le
fuseau mitotique se forme à la fin de la prophase, dans le cytoplasme, à l’extérieur du noyau.
Ce fuseau est une structure bipolaire, constitué de microtubules et de protéines associées,
dérivée de la duplication des centrosomes et de leur séparation.
2- La prométaphase (figure 3.2)
La prométaphase commence au moment où l’enveloppe nucléaire disparait. Les
microtubules formant le fuseau mitotique peuvent alors entrer dans la région nucléaire, et se
différencier en trois types de microtubules différents : les microtubules kinétochoriens qui
s’associent à des complexes protéiques (appelés kinétochores) fixés aux centromères, les
microtubules polaires qui irradient de chacun des centrosomes et interagissent entre eux

!
3!
au milieu du fuseau, et les microtubules astraux qui irradient dans toutes les directions à
partir de chacun des centrosomes.
3- La métaphase (figue 3.3)
Les microtubules kinétochoriens alignent les chromosomes sur un plan situé à mi-distance
de chacun des pôles du fuseau (appelé plaque équatoriale). Chacun des chromosomes est
maintenu à cette position grâce à la traction exercée au niveau des centromères par les
microtubules kinétochoriens irradiant de chacun des pôles.
4- L’anaphase (figure 3.4)
L’anaphase débute soudainement au moment où les chromatides sœurs de chaque
chromosome se séparent et sont alors « tirées » vers le pôle qui leur fait face. Chaque
chromatide constitue alors un chromosome « fils », qui se dirige vers un pôle cellulaire à la
vitesse d’un micromètre par minute. L’anaphase dure seulement quelques minutes.
5- La télophase (figure 3.5)
Les chromosomes « fils » sont arrivés à chacun des pôles du fuseau. Les microtubules
kinétochoriens disparaissent, les microtubules polaires s’allongent encore. Une nouvelle
enveloppe nucléaire se reconstitue autour de chaque ensemble de chromosomes, la
chromatine se décondense et le nucléole, qui avait disparu au moment de la prophase,
commence à réapparaître.
6- La cytodiérèse (figure 3.6)
Le cytoplasme se divise selon un processus appelé clivage ou segmentation, qui commence
pendant l’anaphase. La membrane cytoplasmique située au milieu de la cellule, s’invagine
dans un plan perpendiculaire au fuseau mitotique, créant un sillon de division qui
s’approfondit progressivement, ne laissant persister à la fin qu’un pont cytoplasmique
contenant les restes du fuseau mitotique, appelé corps intermédiaire, qui finit par se
rompre pour donner naissance aux deux cellules filles.
Centrosome
Centre cellulaire, centre organisateur principal des microtubules
(interphase), à l’origine du fuseau mitotique (mitose)
Une paire de centrioles+matrice protéique
Aster
Aspect étoilé du centrosome du fait de la nucléation de multiples
microtubules
Centromère
Région de constriction primaire d’un chromosome mitotique
séquence d’ADN qui permet la fixation du kinétochore et l’attachement
d’un chromosome au fuseau mitotique
Fuseau
mitotique
Ensemble de microtubules et protéines associées qui se forme entre les
deux pôles d’une cellule en mitose
microtubules kinétochoriens+polaires+astraux

!
4!

!
5!
Figure 3 : les différentes étapes de la mitose
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%