Expériences et interprétations

Physiologie animale : les grandes fonctions
Compte rendu de TP :
Mesure de la masse sanguine chez le Rat.
But : Dans ce TP, notre but sera de mesurer le volume de sang (déduit du volume plasmatique
et de l’hématocrite) circulant chez le rat pour en déduire la masse sanguine par rapport à la
masse corporelle.
I. Introduction : le compartiment sanguin
A. Composition
Le sang est un tissu conjonctif : il se compose d’éléments solides, appelés éléments figurés,
qui sont dispersés dans un fluide, le plasma. Il est relativement visqueux (5 fois la viscosité
de l’eau) et possède une densité de 1,05.
1. Le plasma
C’est de l’eau à 90%. La composition en substances minérales est la même que celle des
milieux extracellulaires : on y trouve principalement du sodium (Na) et du chlore(Cl) (d’où
l’utilisation de sérum physiologique (à 0,9% NaCl), qui préserve l’osmolarité du milieu
sanguin) mais il y a également du fer, du cuivre, du zinc et des iodures. On y trouve des
substances organiques telles que les protéines plasmatiques (albumine et globulines). Des
substances azotées comme l’urée (produit de dégradation des protéines), des acides aminés,
de l’acide urique (produit de dégradation des nucléotides), de la bilirubine (produit de
dégradation de l’hémoglobine) ou encore de l’ammoniaque, sont présentes. Il se compose
également de glucose (glycémie = 1g/L) et de lipides variés (triglycérides, phospholipides,
cholestérol…).
2. Système tampon
Le pH de l’organisme oscille autour de 7,4. Pour maintenir cet équilibre le sang possède
différentes façon de rétablir l’équilibre acido-basique en cas de variations.
3. Les éléments figurés
On peut les regrouper en différentes famille de cellules : les érythrocytes, les leucocytes
(polynucléaires, monocytes, lymphocytes) et les thrombocytes. Ils ont tous pour origine les
cellules souches de la moelle osseuse. Ce sont les leucocytes qui sont impliqués dans les
défenses immunitaires de l’organisme. La proportion des différents type de globules blancs
(leucocytes) défini la formule sanguine : chez le rat, on parle de formule sanguine inversée,
c’est à dire qu’il y a plus de lymphocytes que de polynucléaires. Les érythrocytes sont chargés
du transport de l’oxygène dans tout l’organisme ; pour ce faire ils contiennent une protéine,
l’hémoglobine, contenant un atome de fer qui donne sa couleur rouge au sang, qui fixe
l’oxygène afin de la transporter. Les thrombocytes (plaquettes) sont chargés de débuter le
phénomène de coagulation.
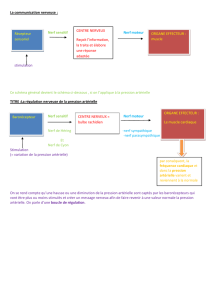
B. Rôle du sang et système vasculaire
Le sang est propulsé par le cœur à travers le système vasculaire. C’est un système de liquide
en vase clos sans citerne. Cependant le système veineux joue indirectement ce rôle ; en effet
celui-ci renferme 60 à 70% du volume sanguin. On retrouve 10 % de sang dans les artères,
environ 5% dans les capillaires, 10% dans les poumons et moins de 10% dans le cœur. Le
sang est maintenu sous pression dans ce système, ce qui permet son déplacement dans les
vaisseaux. Ce système permet au sang d’accomplir son rôle qui est d’apporter les
nutriments et l’oxygène à tous les tissus de l’organisme, et d’en évacuer les déchets (du
métabolisme par exemple).
II. Principe des manipulations
On utilisera des techniques opératoires : le cathétérisme de la veine jugulaire et de l’artère
carotide.
Après la pose des cathéters, on injecte une solution d’héparine à 1% (anticoagulant) par la
jugulaire pour, d’une part éviter la formation de caillots, et d’autre part pour l’analyse du
sang : en effet il est nécessaire que le sang ne coagule pas pour réaliser les mesures.

Sang hépariné : Si le sang n’est pas hépariné, il coagule : ce qui fait apparaitre 2 phases,
l’une étant le sérum et l’autre étant le « coagulum ». Lors de la coagulation, une protéine
plasmatique est mise en jeu, le fibrinogène qui, une fois convertie en fibrine par la thrombine
(une autre protéine), forme une maille qui emprisonne les éléments figurés (érythrocytes,
thrombocyte et leucocytes). Le sérum est donc le plasma sans le fibrinogène. L’héparine
bloque ce phénomène en empêchant la formation de thrombine. On peut séparer le plasma des
éléments figurés d’un sang hépariné en le centrifugeant.
A. Cathétérisme de la jugulaire
Le Cathéter posé au niveau de la jugulaire nous permettra d’injecter un colorant, le Bleu
Evans, qui va diffuser et être dilué dans le volume sanguin. On injecte une quantité
déterminée Q d’une solution du colorant à 2g/L. L’injection dans la jugulaire permet un
passage rapide par le cœur et donc une diffusion rapide dans tout le système vasculaire.
Avantages de l’utilisation du Bleu d’Evans : c’est un composé non toxique. Il demeure dans
le sang du fait de sa liaison aux protéines plasmatiques (au moins le temps de notre
expérience) : il sera alors mesurable dans le plasma après centrifugation. Il n’est pas
métabolisé (pas durant l’expérience). Il est mesurable facilement en utilisant un
spectrophotocolorimètre (à 580 nm)
B. Cathétérisme de la carotide
On pourra ensuite récupérer du sang, par le cathéter de la carotide (Le prélèvement se fait à
partir de l’artère Carotide car on a un débit sanguin plus important, celle-ci arrivant
directement de la crosse aortique, située à la sortie du ventricule gauche, qui propulse le sang
oxygéné dans tout l’organisme), afin de déterminer la concentration C en Bleu Evans et
alors déterminer la dilution effective et en déduire le volume plasmatique Vp. En fait, on
centrifuge le sang : on aura 2 phases, le surnageant étant le plasma qui contient le colorant. On
détermine alors la concentration C en bleu d’Evans dans le plasma grâce à une gamme
étalon réalisée au préalable. On doit aussi réaliser un Hématocrite Ht (mesure du
pourcentage des érythrocytes = volume globulaire Vg) pour pouvoir ensuite déterminer le
volume sanguin Vs.
Vp = Q / C
Vp (en %) = 100% - V globulaire(en%) : Vs = Vp x (100/(100-Ht))
III. Expérience et résultats
On a injecté un volume de Bleu d’Evans, à 2 g/l, en fonction du poids de l’animal : 0,5 ml /
kg
Notre Rat pesait 340 grammes : 0,5 x 0,340 = 0,17 ml ; on injecte alors 170 µl du colorant au
niveau de la veine jugulaire, ce qui représente 340 µg.
On récupère, au bout de 5 minutes après la fin de l’injection, du sang par le Cathéter de la
carotide et, après centrifugation, on récupère le surnageant pour lire l’absorbance à 580 nm.
A. Problème : lecture directe impossible
On est en présence d’une solution trop concentrée pour une lecture fiable du
spectrophotomètre : en effet la mesure d’absorbance doit être comprise entre 0,05 et 1,2. Or la
concentration est telle que la mesure d’absorbance est plus grande que 1,2. On réalise alors
une dilution de la solution pour que sa concentration soit telle que la valeur d’absorbance soit
comprise entre 0,05 et 1,2. On dilue la solution au 1/6ème : on trouve une valeur
d’absorbance A égale à 0,612.
B. Courbe d’étalonnage
Pour faire une courbe étalon, on réalise des dilutions à partir de la solution de départ pour
obtenir des valeurs d’absorbances comprises dans l’intervalle fiable (entre 0,05 et 1,2). La
solution de départ est à 2g/L.
Dilution par rapport à la solution mère
Concentration (en g/L)
Absorption
1/160
1,25E-02
1,176
1/320
6,25E-03
0,622

1/640
3,13E-03
0,330
1/960
2,08E-03
0,221
1/1280
1,56E-03
0,193
1/1720
1,16E-03
0,130
1/2560
7,81E-04
0,095
On peut alors positionner les points sur le graphique ci-dessous.
On trace une droite de régression linéaire : on constate qu’elle passe par 0 et que le coefficient
de détermination R2 est très proche de 1. La droite est donc relativement fidèle aux points
expérimentaux.
On utilise ensuite l’équation de la droite, y = 96,37x, pour déterminer la concentration en Bleu
Evans. (y correspond à l’absorbance et x à la concentration)
Concentration plasmatique = Cp = (A / 96,37) x 6 (dilution au 6ème) = 3,81.10-2 g.L-1
On doit calculer le volume total de notre produit, comme vu précédemment : Vp = Q/C. On
doit déterminer Q. Notre solution est à 0,2 %, on a donc Q = 170 x 0,2 = 0,34 µg de produit
injecté.
Vp = 0,34 (µg) / 3,81.10-2 (µg/ml) = 8,92 ml
L’hématocrite nous a permis de mesurer la proportion en éléments figurés : Il y en a environ
47% dans le sang. On en déduit alors le volume sanguin total.
C. Volume et masse sanguine
Vs = Vp x (100 / (100-Ht))
Ici, Vp = 8,92 mL
Ht = 47% Donc Vs = 8,92 x (100 / (100-47))= 16,21 mL
On en déduit la masse sanguine : en supposant une masse spécifique du sang à 1g/mL, on
obtient une masse sanguine de 16,21 g.
On peut en déduire en pourcentage, le rapport masse sanguine/ masse corporelle :
(16,21 / 340) x 100 = 4,8 %
On remarque que ce rapport est assez bas. Ceci est dû à quelques problèmes rencontrés lors
des manipulations.
IV. Interprétation des résultats et analyse des erreurs cumulées
Comme nous l’avons signalé précédemment, nous avons rencontré un certain nombre de
mésaventures pendant nos manipulations.

En effet, nous avons provoqué des pertes de sang, au cours de la pose des cathéters. En
dégageant les couches de muscles pour accéder à la carotide, nous avons provoqué une
hémorragie, possiblement due à la lésion de la jugulaire.
De plus, Une carotide a été sectionnée, à cause d’une erreur lors de l’introduction du cathéter,
provoquant de ce fait une forte hémorragie, limitée tant bien que mal par la pose d’une pince
clamp.
Une dernière hémorragie, d’origine plus profonde et inconnue, est survenue lors de la 2ème
tentative de pose de cathéter carotidien (qui fut au final un succès).
Toutes ces maladresses ont fait perdre à notre rat une forte quantité de sang, le volume
sanguin mesuré par l’expérience est donc faussé, nos résultats étant inférieurs à ceux attendus.
On aurait théoriquement du trouver un volume de sang d’environ 30 mL. Il aurait fallu
évaluer la quantité de sang perdu lors des hémorragies pour s’approcher de la valeur réelle.
Nos résultats nous conduisent à un volume sanguin restreint (16,21 mL), on suppose donc que
l’on a perdu entre 10 mL et 20 mL de sang, au cours de notre expérience.
Des erreurs peuvent également survenir lors de l’injection du colorant. En effet, on injecte un
volume très faible, ce qui augmente le pourcentage d’erreurs possible, en relation avec la
précision du matériel utilisé. Cependant, en manipulant avec précision, on peut rendre ce
quasiment nul.
On peut également imputer des erreurs à l’établissement de la gamme étalon, les dilutions
ayant été faites en cascade, si la première était faussée (erreur de pipetage par exemple),
toutes les autres l’étaient aussi. Le matériel utilisé (micropipette) étant précis, il permet, à
conditions de manipuler correctement, d’être confiant par rapport à la précision des dilutions
effectuées. On constate une bonne qualité de la gamme étalon, le coefficient de détermination
R2 (mise en évidence du taux d’erreur) étant quasiment égal à 1 (voir courbe étalon).
V. Conclusion
Ce TP nous a permis de déterminer le volume sanguin restant après les hémorragies. On a
donc pu déterminer la masse sanguine correspondante, malheureusement, on ne peut pas
déterminer la masse réelle, à cause des différents problèmes rencontrés.
Pour conclure sur la méthode employée, on peut dire qu’elle peut s’avérer très intéressante et
précise, dans le cas d’une manipulation parfaite (sans hémorragies). On ne pourrait pas
obtenir de si bons résultats en « saignant » l’animal, car une partie du sang resterait dans les
vaisseaux sanguins. En effet, le produit diffusant dans tout le système vasculaire, on peut en
déduire avec précision le volume total de sang, grâce à la dilution effective. Le temps de
diffusion étant assez court, on limite également l’élimination rénale, qui pourrait fausser les
résultats dans le cas d’une diffusion plus longue.
Etude de la Diurèse osmotique
VI. Introduction
L’objectif de ce TP est d’étudier les effets de l’adjonction de liquide physiologique (NaCl
0.9%) d’une part, et une solution de mannitol (10%) d’autre part, dans le liquide plasmatique
via la veine jugulaire, sur la diurèse.
Ces effets seront comparés à la diurèse du rat dans les conditions basales à travers la première
expérience qui nous servira de témoin.
L’injection doit être pratiquée dans une veine où la solution inoculée se mélangera rapidement
avec le sang circulant.
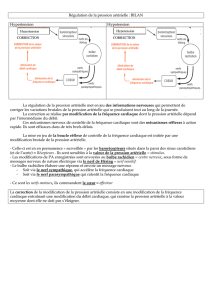
De plus, il existe un lien fonctionnel entre la circulation sanguine et le rein.
Au niveau du glomérule, un très grand volume de liquide est filtré à partir du sang (taux de
filtration glomérulaire = TGF) dans le tubule (urine primitive) et contient, outre l’eau, les
petites molécules du plasma. Par la suite, au niveau du tubule et du tube collecteur, les
constituants de l’urine primitive retournent dans le sang à travers la paroi du tubule
(réabsorption), et ce, dans des proportions différentes selon la substance (par exemple
Certains aspects sont peu clairs. Tout graphique (courbes) doit porter des titres pour l’abscisse et
l’ordonnée.

urée<<glucose) et en quantité variable pour la même substance selon les besoins (régulation).
Le reste du filtrat est éliminé avec l’urine (excrétion).
L’influence du taux d’hormone antidiurétique (ADH) ou vasopressine dans le plasma ne sera
pas abordée au cours de ce T.P. Il faut tout de même préciser que cette hormone a un rôle de
régulation très important dans la diurèse en agissant sur la perméabilité du tube collecteur.
Cependant, les effets intervenant après un temps assez long, nous ne les avons pas vus au
cours de ce T.P..
VII. Expériences et interprétations
A. Conditions basales
Après avoir ligaturé les voies naturelles afin d’éviter les pertes d’urine par le canal
excréteur (l’uretère), on recueille l’urine dans une pipette de 2 mL grâce à un cathéter
introduit dans la vessie et relié à cette pipette.
On mesure ainsi le volume d’excrétion d’urine en fonction du temps.
Les interprétations des expériences suivantes seront établies à partir des résultats obtenus dans
ces conditions basales (expérience témoin).
1. Observations
On constate que l’urine monte lentement dans la pipette avec un débit relativement faible qui
est d’environ 0.002mL par minute en moyenne. Ceci correspond aux conditions basales du
fonctionnement du rein.
2. Interprétation
L’urine est élaborée en deux temps : le plasma sanguin est tout d’abord filtré au niveau du
glomérule, ceci aboutit à la formation d’un gros volume que l’on appelle urine primaire, et
dont la composition est très différente de l’urine définitive.
Lors d’une seconde étape, l’urine primitive est récupérée par le tubule qui fait suite au
glomérule et en réduit considérablement le volume, tout en modifiant la composition
chimique. Le tubule rénal réalise un énorme effort de concentration via différents segments
cellulaires, du tube contourné proximal au tube collecteur.
Au final, près de 99% de l’eau ainsi que des électrolytes contenus dans l’urine sont
réabsorbés : cela aboutit à l’excrétion de l’urine définitive.
Tout ceci pour expliquer l’efficacité du rein dans les conditions basales qui produit un volume
très faible d’urine ; justifiant l’injection d’un liquide physiologique qui a pour effet
d’augmenter la diurèse.
B. Injection du liquide physiologique
On injecte une solution de liquide physiologique contenant du chlorure de sodium à 0.9%
dans la veine jugulaire et on recueille à nouveau l’urine dans une pipette de la même manière
que précédemment.
1. Observations
En comparaison avec les résultats obtenus dans les conditions basales, on constate après
injection d’un sérum physiologique, une augmentation de la production d’urine avec un débit
plus élevé qui est d’environ 0.015mL par minute.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
1
/
27
100%