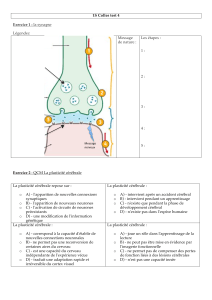
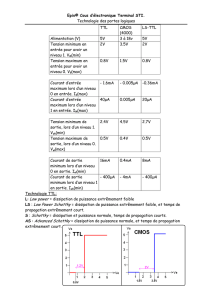
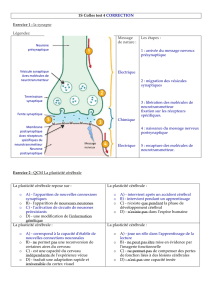
Cours 3 Thermodynamique des processus irréversibles

3. Thermodynamique
des processus irréversibles
en mécanique des milieux
continus
Marc François

Introduction
•La plasticité est irréversible : il y a dissipation
thermique intrinsèque
•Thermo. classique : transformations réversibles
•T.P.I.
Onsager (Nobel 1968),
Prigogine (Nobel 1977)
•Application à la mécanique
Germain (1970) Halphen (1975),
Lemaitre (1977)

Variables
•L’état du système est décrit par les variables
d’état (V.E.). En mécanique :
•Les variables!!!!! sont des variables
internes. En plasticité, on a au moins !!!!!
parmi elles.
•Les variables associées (V.A.) sont

Méthode de l’état local
•Tous les états sont considérés comme des états
d’équilibre.
•Les V.A. sont associées aux V.E. (et pas à leur
dérivées) par l’énergie libre de Gibbs (ou potentiel
d’état). Il décrit les états d’équilibre et les
évolutions réversibles.
•Les évolutions irréversibles sont décrites par les
V.E. (ou les V.A.) et leur dérivées par rapport au
temps.
En plasticité, seulement les V.A.

Énergies
•Travail des efforts
extérieurs
•Travail des efforts
intérieurs
•Quantité de chaleur
reçue de l’extérieur
•Quantité de chaleur
produite en interne par
dissipation
•Énergie interne
•Entropie
•Énergie libre de Gibbs
extérieur
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
1
/
31
100%