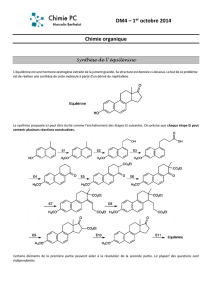
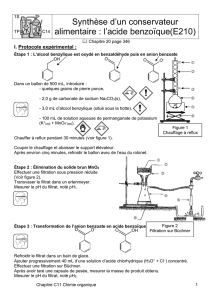
4 Nomenclature inorganique - théorie

1DF
4.1 Vocabulaire à apprendre à maîtriser dans ce chapitre
Nomenclature Nom commun Nom chimique
Pseudo ion Acide
4.2 Compétences à acquérir au cours de ce chapitre
A la fin de ce chapitre vous devriez être capable de
• Reconnaître et différencier les noms commun et chimique d’un composé.
• Nommer les molécules inorganiques à partir de leur formule brute, en vous aidant
de la table CRM.
• Trouver la formule brute d’un composé inorganique à partir de son nom chimique,
en vous aidant de la table CRM.
4.3 Introduction
Pour différencier les molécules les unes des autres, les chimistes leur ont attribué un nom.
Il existe deux types de nom :
• Le nom chimique : Celui-ci est attribué à la molécule en fonction des éléments
qu’elle contient en suivant des règles précises.
• Le nom commun : celui-ci a généralement un origine historique. C’est aussi celui
utilisé par les non initiés.
Exemple: NaOH - Nom chimique : Hydroxyde de sodium
- Nom commun : soude caustique
4.4 Procédure pour attribuer les noms des molécules
Nous distinguerons 3 catégories de molécules :
- les composés contenant au moins un métal
-
les composés formés seulement de non-métaux
-
les acides.

1DF
La nomenclature inorganique
2
4.4.1 Les molécule contenant au moins un métal
Dans cette section, on distinguera les composés
- contenant un(des) métal(aux) avec un seul nombre
d’oxydation.
- contenant un(des) métal(aux) avec plusieurs nombres
d’oxydation.
4.4.1.1 Procédure pour nommer les molécules contenant des métaux qui ont un
seul nombre d’oxydation
A) Prendre la formule brute de la molécule.
B) Séparer la molécule en (pseudo) ions.
On parle de pseudo ion lorsqu’il n’y a pas de liaison ionique dans la molécule.
C) Attribuer le nom de la molécule selon le principe suivant :
nom du (pseudo) anion + particule ‘’de’’ + nom du (pseudo)cation
• Le nom et la formule brute des (pseudo)anions courants, ainsi que de certains
cation, se trouvent, dans la table CRM, dans le tableau intitulé ‘’Nomenclature de
quelques molécules et ions en solution’’.
• Le nom d’un cation monoatomique est toujours le même que celui de l’élément
correspondant.
Exemple: A) Na
2
CO
3
B)
Cation = Na
+
Anion = CO
32-
C) Na
+
= sodium CO
32-
= carbonate
Nom de la molécule = carbonate de sodium
4.4.1.2 Procédure pour nommer les molécules contenant des métaux qui ont
plusieurs nombres d’oxydation
Certains métaux ont plusieurs nombres d’oxydation. Ils peuvent donc faire un nombre
variable de composés avec les mêmes (pseudo)anions.
On utilise alors de nombre d’oxydation du métal pour différencier le nom de ces
composés.
Le nombre d’oxydation du métal est écrit après le nom de la molécule entre parenthèses
et en chiffre romain.
nom du (pseudo) anion + particule ‘’de’’ + nom du (pseudo) cation
+ nombre d’oxydation du métal en chiffre romain entre parenthèse

1DF
La nomenclature inorganique
3
Exemple:
Le Plomb = Pb N.O.= +2, +4
Avec l’anion chlorure (Cℓ
-
), le plomb peut former deux molécules.
N.O. du plomb
Formule brute Nom*
+2 PbCℓ
2
chlorure de plomb
+4 PbCℓ
4
chlorure
de plomb
*Selon la règle du paragraphe 4.4.1.1, les deux molécules ont le même nom. Il faut donc
rajouter une information dans le nom des molécules pour les différencier.
Avec le nombre d’oxydation du métal, les noms deviennent :
N.O. du plomb
Formule brute Nom
+2 PbCℓ
2
chlorure de plomb (II)
+4 PbCℓ
4
chlorure
de plomb (IV)
4.4.2 Le nom des molécules ne contenant que des non-métaux
4.4.2.1. Les corps purs simples diatomiques
Les corps purs simples diatomiques portent le nom de l’élément qui les compose, précédé
du préfixe di-.
Exemple : Cl
2
dichlore
H
2
dihydrogène
4.4.2.2. Les corps purs composés
Lorsque la molécule est un corps pur composé et n’est composée que de non-métaux, le
nom est attribué en séparant la molécule en pseudo ions. On ajoute ensuite des préfixes
qui indiquent le nombre de pseudo cations et de pseudo anions.
En résumé :
Préfixe nom du pseudo anion
+ particule ‘’de’’ +
préfixe nom du pseudo cation
Nombre de
- pseudo anions
- pseudo cation
1
2
3
4
5
Préfixe Mono* di tri tétra penta
* Il n’y a pas de préfixe devant le nom du pseudo cation lorsqu’il n’en a qu’un seul.

1DF
La nomenclature inorganique
4
Exemples : N
2
O
5
pentoxyde de diazote
N
2
O monoxyde de diazote
Exemples : PCl
3
trichlorure de phosphore
CO monoxyde de carbone
4.4.3 Les acides
• La formule brute des acides commence toujours par H.
• Leur nom commence toujours par le mot ‘’acide’’.
• Le nom et la formule brute des acides courants se trouve dans la table CRM dans
le tableau intitulé ‘’Nomenclature de quelques molécules et ions en solution’’.
4.4.4 Comment faire si l’anion n’est pas dans la table CRM ?
4.4.4.1 Le nom des anions monoatomiques
Tout les anions monoatomiques ont un nom qui finit en –ure, à l’exception de O
2-
qui est l’anion oxyde.
La terminaison est précédée par le nom de l’élément. Cependant ce n’est pas
forcément le nom de l’élément en français qui est utilisé. De plus, la fin du nom de
l’élément peut être tronquée.
Exemples : Te = tellure Te
2-
= tellurure
N = azote, mais ‘’nitrogen’’ en anglais N
3-
= nitrure ≠ nitrogènure
S = soufre, mais ‘’sulfur’’ en anglais S
2-
= sulfure
Se = sélénium Se
2-
= seléniure ≠ séléniumure
P = phosphore P
4-
= phosphure ≠ phosphorure
4.4.4.2 Le nom des anions polyatomiques contenant de l’oxygène
Tous les anions polyatomiques contenant de l’oxygène ont leur nom qui finit en –ate ou en
–ite.
Lorsque l’atome de l’anion qui n’est pas de l’oxygène a le n.o. le plus grand qu’il peut
atteindre, le nom de l’anion finit en –ate.
La terminaison est précédée par le nom de l’élément qui n’est pas de l’oxygène.
Cependant ce n’est pas forcément le nom de l’élément en français qui est utilisé. De
plus, la fin du nom de l’élément peut être tronquée.
Exemples : CrO
42-
N.O. de Cr = +6 (n.o. max.) nom = chromate
SeO
42-
N.O. de Se = +6 (n.o. max.) nom = sélénate
AsO
43-
N.O. de As = +5 (n.o.max.) nom = arsenate

1DF
La nomenclature inorganique
5
Lorsque l’atome de l’anion qui n’est pas de l’oxygène a le (n.o. le plus grand – 2) qu’il
peut atteindre, le nom de l’anion finit en –ite.
Exemples : PO
33-
N.O. max. de P = +5 N.O. de P dans l’anion = +3 = +5 – 2
nom = phosphite
Pour trouver l’anion qui finit en –ite, il suffit de prendre l’anion qui finit en –ate et de lui
enlever un atome d’oxygène ou vice-versa pour trouver l’anion en ate
Exemples :
-ate
- ite NO
3-
= nitrate
→
−Oxygène1
NO
2-
= nitrite
SeO
42-
= sélénate
→
−Oxygène1
SeO
32-
= sélénite
-ite
-ate SO
32-
= sulfite
→
+Oxygène1
SO
42-
= sulfate
PO
33-
= phosphite
→
+Oxygène1
PO
43-
= phosphate
Les non-métaux qui n’ont pas de paires libres, ne forment pas d’anion en – ite.
Exemples : BO
32-
borate le borite n’existe pas
CO
32-
carbonate le carbonite n’existe pas
En résumé :
Anion en -ite Anion en -ate = N.O. max
N.O. de -ite + 2
N.O. max. - 2
+ 1 oxygène.
- 1 oxygène.
Lorsque l’atome de l’anion qui n’est pas de l’oxygène, à beaucoup de paires libres ou
beaucoup de nombres d’oxydation, il existe plus que deux anions polyatomiques
possibles.
C’est le cas de tous les halogènes.
Comme décrit précédemment, le nom des anions finissent tous en –ite ou en –ate et
pour distinguer deux anions dont le nom a la même terminaison, on ajoute un préfixe.
Exemples :
préfixe hypo + terminaison en –ite : BrO
-
hypobromite
IO
-
hypoiodite
sans préfixe + terminaison en –ite : BrO
2-
bromite IO
2-
iodite
sans préfixe + terminaison en –ate :
BrO
3-
bromate
IO
3-
iodate
 6
6
1
/
6
100%