les exercices corrigés

Corrigé fiche CQFR n°2
Activités 7, 8 et 9 Exercice n°3 p.146
B : spectre d’émission de raies ;
C : spectre d’absorption ;
A : spectre d’émission continu.
Activité 10 Exercices n°6 p.146, n°7 p.147, n°14 p.149
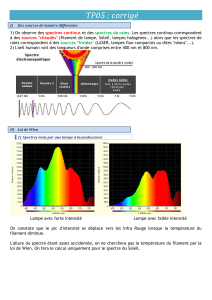
6.
a. Nous savons d’après l’activité expérimentale que plus un spectre est enrichi en radiations de
longueurs d’onde les plus basses (bleu) et plus il émet à une température supérieure. Nous pouvons
constater que l’étoile Véga possède un spectre plus enrichi en radiations bleues que l’étoile
Bételgeuse ; on en conclut que la température de l’étoile est supérieure à celle de Bételgeuse.
b. Les radiations noires ou sombres sur le spectre continu de lumière blanche sont dues à
l’absorption des raies initialement colorées par certaines espèces chimiques présentes dans les
couches gazeuses entourant l’étoile.
-----------------------------------------------------------------------------------------------------------------
7. Premièrement, une espèce chimique gazeuse ne peut absorber que les radiations qu’elle est
capable d’émettre ; ainsi cette espèce peut être identifiée soit par son spectre d’émission, soit par
son spectre d’absorption, les deux spectres étant complémentaires.
Deuxièmement, si il y a plusieurs espèces chimiques présentes dans un gaz, le spectre final est la
somme des spectres de chaque entité.
Par comparaison entre les spectres, on peut remarquer que le spectre de l’étoile contient des raies
absorbées des spectres A et C.
-----------------------------------------------------------------------------------------------------------------
14. a. Le rayonnement émis par Bételgeuse est le plus intense pour la longueur d’onde
9,1 102 nm.
b. Cette radiation est dans l’infrarouge (non visible). Les radiations visibles les plus proches
sont les radiations rouges.
c. D’après la question b, en lumière visible, le maximum d’émission de lumière par Bételgeuse
se produit dans le rouge : Bételgeuse est donc une étoile rouge.
Activités 11, 12 et 13 Exercices n°4 et 9 p.160
4. Méthode
Données : charge élémentaire e = 1,6.10-19 C. Charge d’un noyau Q = 8,0.10-19 C
a. Dans un noyau, la charge élémentaire est celle d’un proton. D’après le cours, il est chargé +e où
e représente la charge élémentaire.
b. Question : Calcul du nombre de protons contenu dans le noyau de charge Q.
Argumentation : par définition, la charge totale Q est la somme des N protons contenus dans le
noyau en question.
Expression littérale : ainsi Q = N.e ce qui donne l’expression littérale :
On encadre l’expression littérale E.L.
Puis on fait l’application numérique : A.N : N =
= 5
Phrase : Ainsi et d’après le calcul, le noyau de charge Q contient 5 protons.
N =
-----------------------------------------------------------------------------------------------------------------
9. Par définition, le symbole chimique de tout élément s’écrit :
où A représente le nombre de
nucléons et Z le nombre de protons. Le nombre de neutron s’en déduit par la relation N = A – Z. D’où
le tableau suivant :

Nom
Symbole
Nucléons A
Protons Z
Neutrons N
Lithium
Li
A = Z + N =3+4 = 7
3
4
Sodium
Na
23
Z = A-N = 23-12 = 11
12
Soufre
S
32
16
N = A-Z = 32-16 = 16
-----------------------------------------------------------------------------------------------------------------
Activités 14 Exercices n°15 p.161 et n°12 et 13 p.177
15. a. L'atome de fluor possède 9 protons, 10 neutrons et 9 électrons ; l'atome de chlore
possède 17 protons, 18 neutrons et 17 électrons.
b. F : (K)2(L)7 ; Cl : (K)2(L)8(M)7.
c. On observe que les noyaux de fluor et de chlore ont le même nombre d'électrons sur leur
couche externe.
-----------------------------------------------------------------------------------------------------------------
12.
a. Les 5 premiers éléments chimiques jusqu’au Bore, vont acquérir une structure électronique
identique à celle de l’Hélium soit 2 électrons sur la couche externe, gaz noble le plus proche, dans le
cadre de leur transformation soit en ion, soit dans un édifice chimique.
Idem pour les autres éléments mais la couche externe contiendra 8 électrons.
b.
Symbole
Li
Al
O
Br
Z
3
13
8
35
Gaz le plus
proche
He (z=2)
Ne (z=10)
Ne (z=10)
Kr (z=36)
Nbre d’électrons
gagnés ou perdus
par l’atome
1 é perdu
3 é perdus
2 é gagnés
1 é gagné
Formule de l’ion
Li+
Al3+
O2-
Br-
----------------------------------------------------------------------------------------------------------------
13. a. Voir 12. a.
b.
Activité 16 Exercices n°15 p.193 et 21 p.195
15. a. Si.
b. L’élément Si appartient à la 3e période de la classification. Sa couche externe est la couche L.
c. Il appartient à la colonne 14 : il y a donc 4 électrons sur sa couche externe. Sa configuration
électronique est la suivante : (K)2(L)8(M)4.
d. P : (K)2(L)8(M)5
S : (K)2(L)8(M)6
Cl : (K)2(L)8(M)7
Ar : (K)2(L)8(M)8
-----------------------------------------------------------------------------------------------------------------
21. a. O est situé sur la deuxième période et dans la 16e colonne de la classification périodique :
il forme facilement O2-.
b. L'entité X2O3 est neutre, donc l'élément X forme facilement l'ion X3+.
c. X appartient donc à la troisième colonne.
d. Q = Z' e, avec Z' le nombre d'électrons de l'ion X3+.

L'ion X3+ possède trois charges positives, donc Z = Z' + 3.
Z = 13, X est donc l'aluminium, de symbole Al.
1
/
3
100%