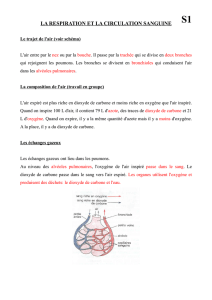
1S Chimie La carie dentaire Exercice résolu

P a g e | 1
La carie dentaire Document : N.Sayed - CPF - Beyrouth
1S
Chimie
La carie dentaire
Exercice
résolu
Remarque : Sauf indication contraire, toutes les réponses sont à justifier.
Introduction
Dans les effets indésirables de la notice d'un médicament cardiaque on peut lire : «
Ce médicament rend la
bouche sèche, ce qui favorise la formation des caries dentaires, il est conseillé de se brosser les dents au moins
trois fois par jour au cours du traitement».
La carie dentaire est une maladie des dents, caractérisée par la destruction progressive de la couche externe
de la dent : l'émail. Elle est due surtout à une carence (un manque) en calcium dans la cavité interne de la dent :
la pulpe dentaire. La pulpe absorbe le calcium de l'émail.
L'émail d'une dent est principalement constitué d'un solide ionique le carbonate de calcium de formule CaCO3,
celui-ci peut réagir avec les débris alimentaires surtout les acides.
Afin d'étudier la cause de la carence en calcium, on réalise une étude expérimentale qualitative et quantitative
de l'action de l'acide citrique sur la coquille d'un œuf, sachant que celle-ci est formée de carbonate de calcium.
Première partie : l'acide citrique
L'acide citrique est présent dans les fruits acides (citron,
orange…) et aussi dans le yaourt. C'est un électrolyte solide,
soluble dans l'eau et sa formule est C6H807 : c'est un
triacide carboxylique.
La formule semi - développée de l'acide citrique est donnée
ci-contre.
1. Un acide carboxylique a pour formule générale R-COOH,
où R est un radical formé généralement d'atomes de carbone et d'hydrogène. Le groupe C00H est le groupe
carboxyle, c'est le groupe fonctionnel de l'acide. Lors de la dissolution d'un acide carboxylique dans un solvant
polaire, c'est le groupe carboxyle qui subit en fait la dissociation grâce à la différence d'électronégativité des
atomes d'oxygène et d'hydrogène engageant une liaison covalente simple dans le groupe. (-CO0 H)
a) Définir l'électronégativité d'un élément.
b) Expliquer, à partir de la structure semi – développée de l'acide citrique, la raison pour laquelle il est
considéré comme un triacide.
2. Sans aucune justification, répondre aux
questions a, b et c suivantes.
a) Citer, par ordre chronologique, les étapes
de la dissolution d'un électrolyte dans l'eau.
b) Légender le schéma ci-contre en utilisant les
termes suivants : le pôle positif de la molécule
d'eau, le pôle négatif de la molécule d'eau,
l'anion, le cation.
c) Compléter l'équation ci-dessous,
représentant la réaction de dissolution de
l'acide citrique dans l'eau ci-dessous :
C6H807(s) + ….H2O(l) C6H5O7......(aq) + 3H30+(aq)
2
1
3
4

P a g e | 2
La carie dentaire Document : N.Sayed - CPF - Beyrouth
Deuxième partie : l'action de l'acide citrique sur la coquille de l'œuf
Données
- T = θ + 273 où T est la température absolue en degrés Kelvin et θ la température en degrés Celsius.
- La constante des gaz parfaits : R = 8,314 u.S.I.
- Masse molaire du carbonate de calcium : M = 100,0 g.mol-1.
Protocole expérimental
Dans un flacon dont la capacité est V= 850 mL, on introduit un volume V1 = 100 mL d'une solution S0 d'acide
citrique de concentration molaire c1 = 2,0 x 10-2 mol.L-1 en soluté apporté.
Le flacon est fermé par un bouchon à deux trous dans lesquels on introduit un pressiomètre et un thermomètre.
La pression alors mesurée dans le flacon est égale à la pression atmosphérique, elle vaut p0 = 1 025 hPa, et la
température mesurée vaut θ = 20 °C.
On introduit une masse m = 0,20 g de coquille d'œuf dans le flacon et on le bouche rapidement. Une
effervescence apparaît dans le flacon, ce qui indique le dégagement d'un gaz considéré comme un gaz parfait.
On laisse le système évoluer, la pression pf mesurée à la fin de cette évolution vaut 1 090 hPa.
La température finale vaut θ'= 20 °C.
L'équation de la réaction ainsi produite est la suivante:
CaC03(s) + 2H3O+(aq) Ca2+(aq) + CO2(g) + 3H2O(l)
Questions
1. a) Comment peut-on vérifier expérimentalement que le gaz dégagé au cours de la réaction est le dioxyde de
carbone?
b) Etablir une relation entre la pression p du dioxyde de carbone dégagé lors de la réaction, et les pressions p0
et pf, puis donner la valeur de p en Pa.
c) Trouver la quantité de matière n de dioxyde de carbone présente dans le flacon à la fin de l'évolution du
système.
2. a) En se référant à l'équation de dissolution de l'acide citrique, calculer la concentration molaire effective
[H3O+(aq)] des ions oxonium présents dans la solution S0.
b) En déduire la quantité de matière n0 des ions oxonium présents dans la solution S0.
c) Compléter le tableau descriptif de l’évolution de la réaction entre le carbonate de calcium et les ions oxonium.
Equation chimique
Date Avancement
x (en mmol) Quantités de matière n (en mmol)
CaC03(s) H3O+(aq) Ca2+(aq) C02(g) H20(l)
t = 0 Excès
t Excès
tf Excès
d) Tracer et légender le graphique représentant l'évolution des quantités de matière des réactifs et des
produits (exceptée l'eau) en fonction de l'avancement x. Echelle : 1,0 cm
⇔
1,0 mmol. Aucune justification
n'est demandée.
e) Expliquer alors la cause de la carence en calcium dans une dent lors de l'abus en boissons acidifiées et en
manque d'hygiène.

P a g e | 3
La carie dentaire Document : N.Sayed - CPF - Beyrouth
- Corrigé -
Première partie : l'acide citrique
1. a) Définir l'électronégativité d'un élément.
L'électronégativité d'un élément traduit la tendance d'un atome de cet élément à attirer les électrons de la
liaison covalente dans laquelle il est engagé.
b) Expliquer, à partir de la structure semi – développée de l'acide citrique, la raison pour laquelle il est considéré comme un
triacide.
L'acide citrique est considéré comme un triacide car il possède trois groupes carboxyles dont chacun libère un
ion hydrogène en solution.
2. Sans aucune justification, répondre aux questions a, b et c suivantes.
a) Citer, en ordre, les étapes de la dissolution d'un électrolyte dans l'eau.
1ère étape: la dissociation de l'électrolyte en ions.
2ème étape: l'hydratation des ions de l'électrolyte par des molécules d'eau.
3ème étape: la dispersion des ions de l'électrolyte hydratés dans la solution.
b) Légender le schéma, en utilisant les termes suivants: le cation, l'anion, le pôle positif de la molécule d'eau, le pôle négatif de la
molécule d'eau.
1 : Le cation ; 2 : l'anion ; 3 : le pôle positif de la molécule d'eau ; 4 : le pôle négatif de la molécule d'eau.
c) Compléter l'équation ci-dessous, représentant la réaction de dissolution de l'acide citrique dans l'eau ci-dessous:
C6H807(s) + 3 H2O(l) C6H5O73-(aq) + 3H30+(aq)
Deuxième partie : l'action de l'acide citrique sur la coquille de l'œuf
1. a) Comment peut-on vérifier expérimentalement que le gaz dégagé au cours de la réaction est le dioxyde de carbone?
On verse 1 mL environ de la solution S0 dans un tube à essai, on y introduit un morceau de coquille d'œuf et on
bouche rapidement le tube par un tube à dégagement dont l'extrémité plonge dans un tube contenant de l'eau
de chaux limpide, celle-ci devient trouble ce qui indique que le gaz dégagé lors de la réaction est le dioxyde de
carbone.
b) Etablir une relation entre la pression p du dioxyde de carbone dégagé au cours de la réaction, et les pressions p0 et pf, puis
donner la valeur de pf en Pa.
La pression p initialement mesurée est celle de l'air présent dans le flacon. La pression p' est la pression de l'air
et du dioxyde de carbone dégagé alors:
pf = p + p0 d'où p = pf – p0
Soit : pf = 1 090 – 1 025 = 65 hPa ou 6,5 x 103 Pa
c) Trouver la quantité de matière n de dioxyde de carbone présente dans le flacon à la fin de l'évolution du système.
Le dioxyde de carbone dégagé est considéré comme un gaz parfait on a alors d'après l'équation d'état des gaz
parfaits:
p . Vg = n . R . T où Vg représente le volume du dioxyde de carbone dans le flacon.
n = 1
p.(V V )
R.T
− =
3 6
6,5 10 750 10
8,314 293
−
× × ×
×
= 2,0 x 10-3 mol
2. a) En se référant à l'équation de dissolution de l'acide citrique, calculer la concentration molaire effective [H3O+(aq)] des ions
oxonium présents dans la solution S0.
D'après les coefficients stoechiométriques de l'acide citrique et des ions oxonium dans l'équation de dissolution
de l'acide citrique dans l'eau on peut déduire que:
[H3O+(aq)] = 3.c1 Soit : [H3O+] = 3 x 2,0 x 10-2 = 6,0 x 10-2 mol
b) En déduire la quantité de matière n0 des ions oxonium présent dans la solution S0.
n0 = [H3O+(aq)] . V1 Soit : n0 = 6,0 x 10-2 x 100 x 10-3 = 6,0 x 10-3 mol

P a g e | 4
La carie dentaire Document : N.Sayed - CPF - Beyrouth
c) Compléter le tableau descriptif de l’évolution de la réaction entre le carbonate de calcium et les ions oxonium.
Soit n1 la quantité de matière de CaCO3 à l'instant t = 0, on a : n1 =
m
M
Soit : n1=
0,20
100, 0
= 2,0 x 10-3 mol ou 2,0 mmol.
La quantité de matière n de dioxyde de carbone formée est égale à 2,0 mmol (question 1-c)
D'après les coefficients stoechiométriques dans l'équation de la réaction produite on peut déduire que la
quantité de matière de dioxyde de carbone formée est égale à la quantité de matière de carbonate de calcium
consommé qui est égale à l'avancement maximal xmax de la réaction, alors à l'état final on a :
n(CaC03) = 0
n ( H3O+) = 6,0 – 2xmax = 6,0 – 2,0 = 4,0 mmol et n(Ca2+) = xmax = 2,0 mmol
Equation
chimique
CaC03(s) + 2H3O+(aq) Ca2+(aq) + CO2(g) + 3H2O(l)
Date
x
( mmol)
Quantités de matière n (en mmol)
CaC03(s) H3O+(aq) Ca2+(aq) C02(g) H20(l)
t =
0 0 2,0 6,0 0 0 Excès
t x 2,0 – x 6,0 -2x x x Excès
t
f
2,0
0
2,0
2,0
2,0
Excès
d) Tracer le graphique représentant l'évolution des quantités de matière des réactifs et des produits (exceptée l'eau) en fonction de
l'avancement x. Echelle : 1,0 cm
⇔
1,0 mmol. Aucune justification n'est demandée.
CaCO3
----- H3O+
-.-.-.-. Ca2+ et CO2
x (mmol)
0 1 2 3 4 5
n1 (mmol)
1
2
3
4
5
n2 (mmol)
n3 (mmol)
n4 (mmol)
1
/
4
100%