PHOTOSYNTHESE METABOLISME CARBONNE

LSV – Semestre 3 – Photosynthèse Métabolisme Carboné - 1
PHOTOSYNTHESE METABOLISME
CARBONNE
Super Puppo Sunshine - pu[email protected]
BIBLIOGRAPHIE
• La photosynthèse, H. JUPIN, A. LAMANT, Ed DUNOD
• Physiologie végétale, 1. Nutrition, R. HELLER, R. ESNAULT, C. LANCE, Ed DUNOD
• Physiologie végétale, W. HOPKINS, Ed DE BOECK
INTRODUCTION
GENERALITES
Les plantes synthétisent la matière organique dont elles sont constituées grâce à la photosynthèse, c’est
d’ailleurs cela qui les caractérise. Cette assimilation mettant en jeu deux entités, le gaz carbonique et l’eau, a
lieu à partir de pigments chlorophylliens et un facteur environnemental qui est la lumière. L’acte
photosynthétique sera au final constitué de la combinaison de ces quatre éléments majeurs.
Ce cours sera quasi exclusivement axé sur l’étude des plantes supérieures, pour autant, d’autres organismes
tels certaines algues ainsi que les cyanobactéries sont aptes à cette photosynthèse. Ce mécanisme n’est donc
pas spécifique, et mènera, dans tous les cas à quelques exceptions près, à la production de glucides et
d’oxygène, ce dernier permettant, une fois rejeté dans l’atmosphère, la vie d’un certain nombre d’autres
organismes. On peut d’ailleurs dire de manière simple que le monde végétal est, dans sa totalité, un
fournisseur d’oxygène pour l’intégralité du monde animal. De la même manière, toutes les molécules
hydrocarbonées issues des réactions photosynthétiques constituent la base, non seulement de notre
alimentation, mais également d’une grande variété de matières comme les bois, les textiles, et d’une manière
globale, la biomasse.
HISTORIQUE
D’après la littérature, on estime que le premier article décrivant la photosynthèse fut publié aux environs de
1780 par un chimiste, Priestley. Ce dernier observa et écrit qu’ « à la lumière, les plantes peuvent « restaurer »
de l’air chargé de gaz carbonique et appauvri en oxygène », et ce, après avoir placé une plante ainsi qu’une
souris sous cloche et constaté la survie de la souris.
Durant les années 1920/1930, un biophysicien français, Wurmser, émit l’idée que « dans l’une des étapes [de la
photosynthèse, ndr], l’eau se décompose pour donner de l’oxygène sous l’effet de la lumière ». Le phénomène
fut ensuite décrit en précisant que la réaction de lyse nécessitait une perte d’électrons de la molécule d’eau,
devenant alors un réducteur permettant la formation d’un composé oxydé utilisé par la suite pour réduire le
gaz carbonique en glucides. A ce stade, la trame de fonctionnement de la photosynthèse est en place.

LSV – Semestre 3 – Photosynthèse Métabolisme Carboné - 2
La réaction de consommation du gaz carbonique est alors spatialement et temporellement distincte de la
réaction de lyse de la molécule d’eau : ces découvertes permirent une avancée majeure dans la mise en place
de la compréhension du processus photosynthétique.
Il aura finalement fallu attendre les années 50 pour que les progrès de la biologie moléculaire permettent de
définir les photosystèmes, assemblages moléculaires réunissant pigments et protéines capables de ces deux
réactions principales.
ENERGIE LUMINEUSE ET PIGMENTS
ENERGIE LUMINEUSE
Depuis les travaux d’Einstein et de Planck, on sait que la lumière peut être considérée comme une onde, c’est à
dire un rayonnement électromagnétique caractérisé par son intensité et sa longueur d’onde.
Mais cette définition n’est pas usitée par le biologiste végétal, qui préfère considérer la lumière comme
constituée d’un ensemble de particules de masse nulle, les photons, qui se déplacent dans le vide à la vitesse
c=3.10
8
m/s transportant une énergie / avec h constante de Planck. De cette manière, on peut
calculer pour chaque photon la quantité d’énergie apportée, qui sera d’après la formule cite plus haut
inversement proportionnelle à la longueur d’onde du rayonnement. Ainsi, dans la gamme de réception de la
plante, les photons « dans le rouge » seront bien moins énergétiques que les photons « dans le bleu ».
Dans la gamme des longueurs d’ondes, tous les photons ne seront pas utilisables par la plante. Ainsi, les
biophysiciens ont défini une fraction de radiations utile, les radiations actives pour la photosynthèse ou PAR
« Photosynthesis Active Radiation », qui correspondent donc à la fraction du flux de photons susceptible d’être
absorbée par les organismes photosynthétiques.
Si l’on veut mettre en cohérence les éléments indiqués, nous verrons de quelle façon la plante collectera ces
photons. Mais voyons d’abord quelques paramètres d’écophysiologie : un autre aspect, plus quantitatif, veut
que la lumière du jour qui arrive sur les plantes ait une intensité globale extrêmement variable, car dépendant
de nombreux facteurs.
• Facteurs physiques : couche d’ozone, poussières en suspension, nuages, vapeur d’eau, etc. Par
exemple, des plantes de sous-bois ne recevront pas la même énergie lumineuse que des feuilles de la
canopée.
• Périodicité de l’éclairement au cours de la journée : afin de donner un ordre de grandeur et à titre
qualitatif, si le flux de photons PAR est de 1000 à 12h en plein soleil, chute à 100 si le ciel est couvert, à
10 en sous bois, et à 1 au crépuscule.
• Pour les végétaux aquatiques, les paramètres sont également nombreux et relatifs aux profondeurs,
niveaux et turbidité des eaux, zones de balancement des marées, etc.
STRUCTURE ET ROLE DES PIGMENTS
Les pigments sont situés dans les chloroplastes, plus précisément au niveau des membranes des thylakoïdes. Ils
ne seront cependant pas seuls sur ces membranes, où une grande panoplie de protéines sera présente : en
particuliers transporteurs d’électrons, mais également ATP-synthétases. On note que les membranes
thylakoïdales sont constituées de lipides particuliers leur conférant une extrême fluidité.

LSV – Semestre 3 – Photosynthèse Métabolisme Carboné - 3
STRUCTURE FOLIAIRE & REPARTITION CHLOROPLASTIQUE
Pour faire un rapide rappel sur la structure foliaire d’une
plante eudicotylédone, on trouve dans celle-ci une
nervure médiane ou principale contenant les éléments
conducteurs : le xylème transporteur de sève brute, et
le phloème transporteur généralement descendant de
sève élaborée particulièrement chargée en molécules
glucidiques. Les chloroplastes se retrouveront répartis
dans deux parenchymes différents : un palissadique sur
la face supérieure, et un lacuneux sur la face inférieure
de la feuille.
La photosynthèse ne pouvant avoir lieu qu’à travers d'échanges gazeux, c’est pourquoi il faut donc une arrivée
de CO
2
ainsi qu’une sortie d'oxygène. Ces échanges gazeux se feront très majoritairement via des stomates,
ouvertures épidermiques que l’on
retrouve sur les deux faces de la
feuille. Leur nombre varie selon les
conditions extérieures.
Chez les monocotylées, les nervures
sont parallèles et de taille à peu près
identique. Il n'existe pas de différence
entre les deux faces de la feuille, et
l’unique parenchyme sera lacuneux.
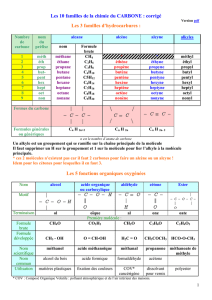
PIGMENTS CHLOROPHYLLIENS
SPECTRE D’ABSORPSION PIGMENTAIRE
Lorsque l’on mesure le spectre d’absorption d’un extrait foliaire
(pigments bruts), on constate que les pigments vont
globalement absorber dans deux ensembles de longueur d’onde
majeurs correspondant aux couleurs bleu et rouge. Un pigment
étant par définition une molécule absorbant des radiations du
spectre visible, un pigment absorbant l’intégralité des radiations
apparaîtra noir, et un pigment n’absorbant pas les radiations
rouges apparaîtra rouge. Généralement, un pigment arborera
donc la couleur des radiations qu’il n’absorbe pas.
Pour expliquer ce spectre d’absorption, il faut regarder la
structure d’une molécule de chlorophylle A, au sein de laquelle
on peut très schématiquement distinguer deux zones : une
longue chaîne hydrocarbonée très clairement apolaire, dite phytol, reliée par une liaison ester à un noyau
tétrapyrrolique. Le positionnement d’un atome de magnésium au sein de ce noyau stabilise l’ensemble de la
structure, qui sera légèrement plus polaire. Ces molécules possèdent de nombreuses liaisons doubles
conjuguées, donc une importante délocalisation électronique, caractéristique majeure pour la récupération de
l’énergie.

LSV – Semestre 3 – Photosynthèse Métabolisme Carboné - 4
Une double liaison est composée de deux paires d’électrons qui n’ayant pas les mêmes caractéristiques :
• Une paire d’électrons σ, relativement pauvres en énergie,
établissent une liaison forte. Ils ne sont pas concernés par le
processus mettant en jeu les photons.
• Une paire d’électrons π, riches en énergie, établissent des liaisons
plus faibles et vont être amenés à changer constamment de position
suite à la délocalisation électronique.
On note que dans chaque cas de délocalisation électronique, il y a absorption
d’une partie du spectre lumineux. La distinction entre les différentes
molécules de chlorophylle se fait uniquement via les substituants du noyau
tétrapyrrolique. Le groupement méthyle de la chlorophylle A et D sera par
exemple remplacé dans la chlorophylle B par un groupement aldéhyde. En
introduisant ces dipôles, les charges partielles induites des carbones portant
ces fonctions auront tendance à modifier légèrement la délocalisation
électronique du noyau tétrapyrrolique, incidemment le spectre d’absorption
de la molécule.
STRUCTURE ET ABSORPTION D’ENERGIE
L’existence d’un noyau tétrapyrrolique n’est pas le propre de la chlorophylle :
les cytochromes et l’hémoglobine en comportent également. La grande
différence résidera dans la nature des atomes centraux. Dans l’espace, la
molécule présente une longue chaîne apolaire, ainsi qu’une zone plus
globulaire. Le noyau tétrapyrrolique est approximé à une sphère de 1,5nm de
diamètre, et la chaîne phytol à 2nm de longueur.
C’est au niveau de ce noyau tétrapyrrolique que va se faire l’absorption de
l’énergie lumineuse. Lorsque les pigments chlorophylliens vont recevoir un
photon ainsi que l’énergie qu’il véhicule, un ou plusieurs électrons π de la molécule verront leur énergie
augmenter et passeront à un niveau énergétiquement plus élevé. C’est un état excité du pigment
chlorophyllien, que l’on note Chl*. Selon la formule de Planck citée précédemment, la chlorophylle ne recevra
pas la même énergie en fonction de la longueur d’onde du rayonnement. Ainsi, vis-à-vis de l’énergie du
rayonnement et de l’absorbance pigmentaire en fonction de la longueur d’onde, il existe deux principaux états
excités des électrons:
• Pour un photon « bleu », l’énergie apportée est supérieure, l’électron est donc portée d’un état
fondamental à un état excité de plus haut niveau énergétique, le deuxième état singulet, de valeur
approximative 270kJ/mol. Cet état extrêmement instable n’est maintenu que pendant 10
-12
seconde,
après quoi l’électron retombe au premier état singulet.
• Pour un photon « rouge », l’énergie apportée est moindre, l’électron est portée d’un état fondamental
à un état excité de niveau énergétique relatif intermédiaire, le premier état singulet, de valeur
approximative 170kJ/mol. Cet état possède une durée de vie largement supérieure, de l’ordre de 10
-8
seconde, permettant une éventuelle création de potentiel électrochimique, incidemment la
conversion entre énergie lumineuse et énergie chimique. La quantité d’énergie apportée par un
photon « rouge » est la quantité d’énergie minimale nécessaire pour cette conversion.

LSV – Semestre 3 – Photosynthèse Métabolisme Carboné - 5
Après 10
-8
seconde au premier état singulet, l’électron doit revenir à l’état fondamental. Il existe trois voies de
dissipation de cette énergie :
• Rayonnement de fluorescence : c’est la voie la moins intéressant vis-à-vis du processus
photosynthétique, l’électron reviendra à son état fondamental en libérant son énergie par un
rayonnement de fluorescence. Ce phénomène peut néanmoins se produire lorsqu’existe un trop-plein
d’énergie sur l’antenne collectrice.
• Résonnance : dans les membranes des thylakoïdes, les pigments et les noyaux tétrapyrroliques sont
proches les uns des autres (distance inférieure à 60 Angstrom), permettant un transfert d’énergie
entre deux pigments adjacents.
• Photochimie : seules certaines molécules de chlorophylle sont capables de ce processus, où l’énergie
absorbée permettra l’éjection d’un électron et le chargement positif de la molécule. On pratique alors
une transformation entre énergie lumineuse et potentiel électrochimique. Les couples Chl
-
/Acc
+
intervenant dans ces mécanismes font partie d’une chaîne d’oxydoréduction.
PIGMENTS CAROTENOÏDES ET AUTRES
Ces lipides sont constitués de 40 carbones et possèdent des
extrémités cyclisées. On y trouve des carotènes, très apolaires,
pouvant être hydroxylées pour former des xanthophylles. Grace à
leurs liaisons conjuguées, ils sont capables de contribuer à la
captation lumineuse en absorbant à des longueurs d’onde
différentes des chlorophylles, et peuvent également contribuer à la
dissipation thermique en cas d’excès de lumière.
On trouve chez d’autres organismes photosynthétiques des
pigments différents au principe de fonctionnement néanmoins
identique comme les phycobilines qui possèdent un noyau
tétrapyrrolique ouvert.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
1
/
36
100%