système de synchronisation entre l


dito
Chers collègues,
Comme tous les deux ans, les élections ont amené un conseil d’administration partiellement renouvelé
qui a élu un nouveau bureau, avec, comme c’est la tradition, des praticiens exerçant en établissements
publics ou en libéral.
Nous souhaitons la bienvenue à Franck Thuny au sein du CA et à Catherine Sportouch-Dukhan et Ludivine
Perdrix dans le nouveau Bureau.
Un grand merci à Juliette Rousseau, Damien Coisne et à Jean-François Forissier pour tout le travail eectué
au cours de leurs mandats respectifs
J’ai en charge la dicile mission de succéder à Jean-Luc Monin, dont l’énergie et l’enthousiasme ont entrainé
la Filiale durant ces 2 dernières années.
Je tiens donc au nom de tous les membres de la Filiale et personnellement à dire « Mille Mercis et BRAVO »
à Jean Luc et à tous les membres du Conseil d’administration pour le travail accompli :
un congrès PARIS-ECHO 2013 particulièrement riche et réussi, la mise sur orbite du Club4D, le
rapprochement avec le groupe scinti IRM, pour ne citer que les principales actions menées.
La force de notre groupe réside dans la continuité de son action, garantie par un trio associant le
président en exercice, le past-président et le vice-président (futur président), mais également dans la
convivialité maintenue avec les anciens présidents et dans l’ouverture vers les générations montantes,
bien représentées dans le conseil d’administration.
2013 a vu notre changement de partenaire, puisque nous avons interrompu notre collaboration avec
l’agence CR2 Conseil, partenaire historique, que je tiens à personnellement remercier pour le travail
accompli pendant toutes ces années.
L’agence Overcome est maintenant notre partenaire pour toute notre communication et pour
l’organisation de notre prochain Congrès PARIS-ÉCHO 2015 qui se tiendra au Palais de Congrès de
Paris du 27 au 29 mai 2015.
Les rendez-vous importants pour vous, échographistes en majorité, mais plus largement cliniciens et
« imageurs » en cardiologie sont :
- La réunion scientique commune du 11 avril 2014, avec le groupe Valvulopathies lors de la journée
des groupes et liales de la SFC à Paris.
- Le Congrès CardioValves à Lille les 17et 18 juin 2014.
- Les Journées de Perfectionnement de Bordeaux 24-26 septembre 2014.
- La réunion scientique du mois d’Octobre 2014 lors de la journée des groupes et liales de la SFC à Paris.
Mes objectifs pour ce nouveau mandat, dans la continuité du travail déjà accompli sont :
- La promotion et la formation aux nouvelles techniques d’échocardiographie,
- l’aboutissement de notre rapprochement avec nos amis du groupe scinti IRM, pour former un groupe
fort d’Imagerie Cardiovasculaire, projet initié par Eric Brochet et poursuivi par Jean-Luc Monin,
- la mise en place d’un site Internet convivial avec des moyens de formation et d’information richement
développés,
- la pérennisation de la publication de notre revue « L’Echo de la Filiale », dirigée par Erwan Donal et
une nouvelle équipe éditoriale,
- la réactivation de la commission recherche, pour une mise en lumière des projets de recherche en
cours et l’incitation à des travaux coopératifs,
- la recherche et la mise en place de nouveaux moyens de communication en plus des réunions scienques
actuelles dont la fréquentation a malheureusement diminué,
- un investissement de notre Filiale dans l’organisation de sessions de DPC.
- et enn une représentation plus nombreuse au sein de l’EACVI
Tout un programme… et celui-là, nous allons vraiment essayer de le réaliser.
Patrick Dehant
02 L’ ÉCHO DE LA FILIALE AVRIL 2014

L’ ÉCHO DE LA FILIALE AVRIL 2014 03
ÉDITORIAL
Patrick Dehant ....................................................................................................................................................................................... 02
ÉTAT DE L’ART
L’imagerie de la myocardiopathie hypertrophique Patricia Réant .............................................................................. 04
Sténose aortique et déformation myocardique Franck Lévy ....................................................................................... 07
Le strain longitudinal global par speckle tracking est il enn prêt pour l’utilisation clinique routinière en 2014 ?
Stéphane Maréchaux .......................................................................................................................................................................... 09
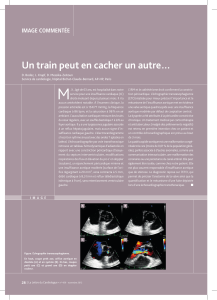
Système de synchronisation entre l’échocardiographie et la uoroscopie en salle de cathétérisme
Julien Ternacle ....................................................................................................................................................................................... 12
LECTURE CRITIQUE D’ARTICLES
Relation dynamique entre asynchronisation ventriculaire gauche et réserve contratile chez les patients implantés
d’un dispositif de resynchronisation Magalie Daudin ....................................................................................................... 14
Thrombolyse dans l’embolie pulmonaire aiguë : est-ce que l’échocardiographie permet de guider la prise en
charge thérapeutique ? Nicolas Mansencal ................................................................................................................................ 15
CAS CLINIQUES
Un désir de grossesse compliqué Marjorie Richardson ....................................................................................................... 17
Endocardite sur prothèse valvulaire : rôle de la tomographie par émission de positon Jennifer Cautela ............... 19
LA VIE DES LABORATOIRES
Laboratoire d’échocardiographie du CHU d’Amiens. Service du Professeur Tribouilloy Hôpital Sud
Franck Lévy ............................................................................................................................................................................................. 22
Laboratoire d’Echo-doppler cardiaque et Unité Inserm UMR1087, Institut du Thorax, CHU de Nantes
Thierry Le Tourneau ............................................................................................................................................................................. 23
COMITÉ DE RECHERCHE
La commission recherche Erwan Donal ....................................................................................................................................... 24
LA PAGE DU CONSTRUCTEUR
Philips .......................................................................................................................................................................................................... 25
AGENDA DES CONGRÈS ...................................................................................................................................................... 26
Président Patrick Dehant
Président sortant Jean-Luc Monin
Vice-président Stéphane Latte
Secrétaire Erwan Donal
Secrétaire adjoint Nicolas Mansencal
Trésorière Ludivine Perdrix
Trésorière adjointe Catherine Sportouch-Dukhan
CONSEIL D’ADMINISTRATION
Philippe Acar
Jean-François Avierinos
Fabrice Bauer
Anne Brunet
Didier Bruère
Jean-Christophe Eicher
Bruno Gallet
Corinne Gautier
Thierry Le Tourneau
Franck Lévy
Arnaud Maudière
David Messika-Zeitoun
Patricia Réant
Juliette Rousseau
Franck Thuny
diRECtoiRE dE LA FiLiALE d’éCHoCARdioGRAPHiE
SoMMAiRE
BUREAU

00 L’ ÉCHO DE LA FILIALE AVRIL 201404
L’imagerie de la myocardiopathie hypertrophique
Patricia Réant patricia.reant@chu-bordeaux.fr
CHU Haut Lévêque - Bordeaux
Les techniques d’imagerie non-
invasives (échocardiographie
de repos et d’eort, IRM cardia-
que) jouent un rôle incontour-
nable lors de l’évaluation initia-
le et pour le suivi régulier des
patients (écho), autant pour
le dépistage de la pathologie,
que pour évaluer sa sévérité
et mettre en place les mesures
thérapeutiques nécessaires.
La prévalence de la myocardiopa-
thie hypertrophique (MCH) dans la
population générale est de l’ordre
de 1/500. Il s’agit d’une pathologie
secondaire à une mutation géné-
tique (qui peut être identiée par
analyses moléculaires du sang dans
60 à 70% des cas) concernant un des
gènes codant pour le sarcomère ;
plus de 13 gènes répertoriés,
plus de 1400 mutations connues.
Dans 42% des cas, il s’agit d’une
mutation sur le gène MYBPC3 et
dans 40% des cas sur le gène MYH7.
Il est important de la dépister
car elle représente la première
cause de mort subite chez les
sujets âgés de moins de 35 ans.
La transmission est autosomique
dominante avec, ainsi, un risque
de transmission de la mutation
de 50% à chaque naissance.
La pénétrance est variable dans
plus de 60% des cas, pour une
même mutation, dans une même
famille, avec possible eet péjoratif
de polymorphismes surajoutés.
Il est conseillé d’adresser les
patients auprès des Centres de
Compétence de la MCH, mis en
place au niveau de la plupart des
CHU en France depuis 2008, an
de réaliser un dépistage familial
(binôme cardiologue-généticien,
médico-légal).
Il est recommandé de réévaluer,
annuellement, le risque rythmique
de chaque patient ainsi que sa
prise en charge thérapeutique ;
par examen clinique, ECG,
échocardiographie, test d’eort et
Holter ECG de 24h (ou, mieux, 48h).
APPORT DE
L’ÉCHOCARDIOGRAPHIE
Elle permet, tout d’abord, le diagnostic
positif de la maladie, caractérisée
par une hypertrophie ventriculaire
asymétrique (ratio de l’épaisseur
pariétale maximale en télédiastole
sur l’épaisseur minimale de la paroi
ventriculaire gauche (VG >1.3) avec
une épaisseur maximale, concernant
généralement le septum inter-
ventriculaire, ≥15mm en cas de cas
isolé ou ≥13mm en présence d’un
antécédent familial de MCH (≥2 SD Z
score chez l’enfant). La cavité du VG
est généralement réduite par rapport
à la normale, <50 mm de diamètre
télédiastolique.
Le VG peut être hyperkinétique,
notamment lorsqu’il s’y associe une
obstruction intra-VG (définie par un
gradient maximal ≥30mmHg au repos
ou lors de manœuvres de provocation
comme l’exercice), au niveau de la
chambre de chasse VG, en cas de
mouvement systolique antérieur de la
valve mitrale (SAM), ou au niveau des
piliers ventriculaires hypertrophiés.
Il convient d’éliminer toute autre
cause d’hypertrophie ventriculaire
secondaire à une élévation de la post-
charge (cardiopathie hypertensive,
rétrécissement valvulaire aortique ou
sous-aortique par membrane sous-
valvulaire), le cœur d’athlète, ou une
hypertrophie secondaire à une mala-
die de surcharge (amylose, hémochro-
matose, maladie de Fabry, syndrome
de Noonan, Danon, etc…). Devant
une hypertrophie concentrique, il
convient de rechercher une amylose
(AL ou à TTR) ou une maladie de Fabry,
même si l’hypertrophie prédomine au
niveau du septum inter-ventriculaire,
car il existe des thérapeutiques ef-
ficaces spécifiques.
L’échocardiographie permet d’ap-
précier le degré de sévérité de
l’hypertrophie, avec une épais-
seur ≥30mm représentant un cri-
tère majeur de risque rythmique.
La répartition de l’hypertrophie selon
la classication de Maron est reliée
au degré de masse ventriculaire, plus
importante notamment en cas de
type III. Dans le type I, l’hypertrophie
concerne le septum basal. En cas de
type II, le septum dans son intégra-
lité est concerné, de la base à l’apex.
Dans le type III, le septum est hyper-
trophié de même qu’une partie de
la paroi libre (inférieure, antérieure
et/ou antéro-latérale). Enn dans
le type IV, l’atteinte concerne soit la
paroi inférieure, soit la paroi latérale,
soit la paroi antérieure, et ce de ma-
nière isolée, ou encore l’apex du VG
(MCH apicale). Lorsqu’il existe une
inversion de la courbure septale, on
découvre plus fréquemment une
mutation génétique (79%), alors
qu’elle n’est retrouvée que dans 8%
des cas quand le septum est sig-
moïde et dans 30% des cas en cas
de MCH apicale. Morphologique-
ment, il faut également rechercher
un anévrysme de l’apex du VG
(Figure 1), exclu par une obs-
truction médio-ventriculaire, ce qui
génère un risque plus important
de thrombus intra-VG, nécessitant
une anticoagulation ecace,
et
d’arythmie ventriculaire.
étAt dE L’ARt
L’échocardiographie permet
de poser le diagnostic positif
de la maladie et d’apprécier
la sévérité de l’hypertrophie
Anévrysme apical du VG, secondaire
à une obstruction médio-ventriculaire,
« excluant » l’apex.
Figure1

L’IRM est un examen
de 2ème intention utile pour
conrmer les cas douteux
et les formes atypiques
Figure 3
La fonction systolique VG peut
être analysée bien que la
fraction d’éjection (FE) ne soit
altérée que dans 5% des cas,
ce qui représente un critère
pronostique péjoratif. Cependant,
il est important de rechercher
une anomalie de la fonction
longitudinale en quantiant le
strain longitudinal global en
speckle-tracking (Figure 2). Une
étude pilote bordelaise, en cours
de publication, a mis en évidence,
sur 116 patients, que le SLG <15%
(en magnitude) est associé à une
survenue d’événements à 20 mois
et à une dégradation clinique plus
fréquente alors que la FEVG est,
elle, normale.
L’échocardiographie permet de
mettre en évidence un mou-
vement systolique antérieur de
la valve mitrale (SAM) avec
contact septal complet, une obs-
truction intra-VG et de quantier,
contrairement à l’IRM, le gradient
maximal de repos et lors de
méthodes de provocation car
ce dernier est dynamique (par
manœuvre de Valsalva ou mieux,
lors d’une échocardiographie
d’eort, à l’acmé de l’eort, en
prenant bien garde à ne pas
aligner le tir Doppler sur un ux
de régurgitation mitrale). Au
repos, 25% des patients porteurs
de MCH sont obstructifs (gradient
maximal ≥30mmHg), le taux
passe à 70% lors de l’exercice,
notamment chez les patients
présentant une dyspnée d’eort.
A noter, qu’il a été montré
récemment que, chez certains
patients asymptomatiques, un
gradient d’obstruction présent au
repos peut régresser à l’effort
(Figure 3).
L’hypertrophie septale conditionne
l’intérêt d’un geste chirurgical
mais n’est pas la seule responsable
de l’obstruction. Il faut en eet
rechercher des anomalies
favorisantes associées :
hyperlaxité des feuillets de la
valvemitrale ou des cordages,
élongation de la grande valve
mitrale, hypertrophie des piliers,
déplacement antérieur ou apical
de l’implantation des piliers
mitraux, piliers surnuméraires
ou bides, insertion directe d’un
pilier sur la grande valve mitrale
plus rare, (Figure 4) prolapsus
valvulaire mitral, angulation de
l’aorte ascendante, ou petite
chambre de chasse.
Lorsqu’elle est secondaire au SAM
et à l’obstruction de la chambre
de chasse, le jet d’insusance
mitrale associée est généralement
excentré vers la paroi latérale de
l’OG alors qu’en cas d’anomalie
organique surajoutée de la valve
mitrale et de l’appareil sous-valvu
laire, le jet est central ou
excentré vers le septum ce qui
nécessite d’envisager la réalisation
d’une intervention pour la traiter,
indépendamment de la myectomie
septale (intervention de Morrow).
Il existe également fréquemment
une restriction ou calcication de
l’anneau ou de la petite valve mitrale
dans la MCH.
Les autres éléments de l’échocar-
diographie sont l’appréciation de la
fonction diastolique VG et des pres-
sions de remplissage VG (ux Doppler
trans-mitral, rapport E/E’, ux veineux
pulmonaire (Am-Ap >-30ms)), le
volume de l’oreillette gauche indexé
en biplan (selon la méthode de l’aire/
longueur ou celle de Simpson) avec,
quand il est >27ml/m², une valeur
pronostique péjorative en terme de
survenue de décès, de brillation
atriale ou d’insusance cardiaque.
Par ailleurs, il convient de quantier
la PAPS et de rechercher une
hypertrophie ± obstruction du
ventricule droit.
Enn, en cas de mauvaise échogéni-
cité, de suspicion de MCH apicale ou
encore lorsqu’une alcoolisation sep-
tale est envisagée, il est recommandé
d’avoir recours à l’échocardiographie
de contraste en utilisant un bolus de
Sonovue® (injection intra-coronaire
en cas d’alcoolisation septale) et en
réduisant l’index mécanique.
APPORT
DE L’IRM CARDIAQUE
En cas de mauvaise échogénicité
ou de suspicion de forme
débutante ou atypique (apicale,
latérale, etc..)(Figure 5), l’IRM
cardiaque est recommandée, en
l’absence de contre-indication.
Insertion directe d’un pilier à l’extrêmité de la valve mitrale antérieure.
La direction du jet
de l’insuffisance mitrale
dépend du mécanisme
de la fuite
Réduction de l’obstruction intra-VG au cours de l’eort chez un patient en classe I
de la NYHA.
Figure 4
Altération plus ou moins sévère du SLG dans la MCH :
A) Réduction uniquement du strain régional au niveau septal basal avec SLG conservé.
B) MCH apicale avec FEVG à 55% mais altération importante, globale du strain
longitudinal VG.
Figure 2
05
L’ ÉCHO DE LA FILIALE AVRIL 2014
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
1
/
28
100%