2. Comportement des composés en présence d`eau

Biochimie
L'eau
L'eau est essentielle à la vie et les espèces vivantes en contiennent des proportions
variables. L'organisme humain contient environ 60% d'eau. Cette quantité varie en
fonction de l'âge, de la nature des tissus (reins 80% d'eau, les os seulement 10%), du
sexe, ...
Cette eau, de l'organisme humain, est compartimentée en plusieurs secteurs hydriques:
Liquide intracellulaire: 40% - Liquide extracellulaire: 20% = Liquides totaux de
l'organisme représentent 60% de la masse corporelle.
Les liquides extracellulaires représentent le plasma (4%) aisin que la lymphe (16%).
Le comportement des biomolécules dépend des caractéristiques physico-chimiques de la
molécule d'eau.
1. Structure et propriétés de l'eau
L'eau est une molécule polaire. La charge de la molécule est nulle mais les électrons des
liaisons covalentes sont répartis de façon différente entre l'oxygène et l'hydrogène. Il
existe une dissymétrie des charges internes d'où une charge ponctuelle, partielle notée ,
qui est positive pour l'H et négative pour l'O. La molécule d'eau est donc « un dipôle
électrique ».
L'eau est une molécule qui est capable de se dissocier = ionisation faible. L'eau peut-être
une base ou un acide. C'est à dire, en solution:
2H20 <=> H3O+ + HO
L'eau est également une molécule qui participe à la création de liaisons hydrogènes
(liaison faible). C'est une liaison des molécules neutres à charges partielles permanentes,
avec mise en commun d'un atome d'Hydrogène en 2 atomes électronégatif (notamment
O, N) qui attirent des e- = cela permet de former un réseau.
2. Comportement des composés en présence d'eau
Composés hydrophiles
Par exemple les gels d'agar, la cellulose, ... Ce sont des substances qui interagissent avec
l'eau en formant des liaisons faibles électrostatiques.
Rmq: toute molécule hydrophile n'est pas forcément hydrosoluble.
Composés hydrosolubles (miscibles)
Ils forment avec l'eau un mélange stable et homogène = une solution aqueuse.
On appel solution, un état liquide homogène constitué d'une phase dispersante: le
solvant, et d'une phase dispersée: le soluté.
Pour qu'une substance soit soluble dans l'eau, il faut que l'attraction entre ces propres
molécules soit inférieure à celle exercée par les molécules du solvant de manière à
permettre sa dispersion.
Dans ce cas, le soluté s'insère au sein d'un réseau de liaisons ionique ou hydrogène, et est
ainsi hydrosoluble, s'il s'agissait d'un solide; on dit miscible s'il s'agit d'alcool.
On parle de suspension dans le cas de particules solides ou d'émulsion pour des
gouttelettes de liquides.

Composés hydrophobes
Substances non chargées, incapables de se lier avec une molécule d'eau.
3. Détermination des volumes des différents secteurs hydriques
Il existe trois compartiments hydriques: intracellulaire, extracellulaire et le plasma.
Le volume de ces compartiments peut-être mesurés en utilisant des substances plus ou
moins diffusibles.
On injecte dans l'organisme connue une substance dont on connait également la capacité
de diffusion. Après un certain temps, on prélève un volume de sang et on détecte la
concentration de la substance dans ce prélèvement. On peut ainsi déterminer le volume
du secteur hydrique exploré. Ce volume dépend des possibilités de diffusion de la
substance.
Si cette substance peut diffuser dans tout l'organisme, on pourra déterminer le volume
de liquide total. Si la substance est arrêtée par la paroi vasculaire, on va pouvoir
déterminer le volume de l'espace plasmatique. Si la substance franchit l'endothélium
vasculaire mais est arrêté par les membranes plasmiques, on peut alors déterminer le
volume des espaces intracellulaires.
4.Mouvements d'eau entre les différents secteurs hydriques
L'eau est toujours en mouvement.
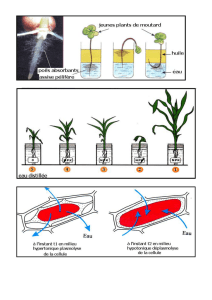
Échanges entre les milieux Intracellulaire et Extracellulaire
Présence d'une membrane plasmique qui est une membrane semi-perméable. Le
phénomène « d'osmose » = mouvement d'eau entre une zone dite hypotonique (la moins
concentrée) vers une zone hypertonique (plus concentrée en soluté). Il s'agit d'un
mouvement spontané. L'osmose dépend de la pression osmotique existant de part et
d'autre de la membrane.
Pression Osmotique: facilité avec laquelle un soluté acquiert de l'eau par osmose.
D'après la loi de Van't Hoff, nous avons la relation suivante:
Π = C . R . T
C = concentration osmotique (qui est différente de la concentration molaire)
T = température en Kelvin (= 273 + T°C )
R = 8,314 = constante des gaz parfaits.
La concentration osmotique tiens compte des particules dissoutes. Par exemple pour
1mol/L de NaCl on a 2osmol/L car par dissolution on obtient 1mole de Na+ et une mole
de Cl-. La pression osmotique intracellulaire est due aux Ca+ et aux protéines.
La pression osmotique extracellulaire est due à Na+ et au Cl-.
Échanges entre le secteur vasculaire et interstitiel
Ces échanges sont sous l'influence de deux pressions: la pression oncotique et la pression
hydrostatique.
Pression oncotique: elle est due aux protéines donc elle tend à attirer l'eau.
Pression hydrostatique: pression exercée par un liquide contre une paroi, elle tend à
faire sortir l'eau des capillaires.
Eau et sels minéraux

1. Comportement des composés en présence d'eau
Composés hydrosolubles
Ces composés forment avec l'eau une SOLUTION aqueuse (soluté + solvant). On parle
de soluté hydrosoluble lorsqu'il était solide avant son contact avec l'eau miscible
lorsqu'il était liquide avant son contact avec l'eau.
Pour obtenir une solution aqueuse:
-> la liaison soluté - soluté doit être < à la liaison eau - soluté
-> il doit exister une liaison de type électrostatique (= liaisons ionique ou liaisons
hydrogènes) entre eau et soluté
ex : NaCl, acide, alcool
-> la diffusion doit être plus importante que la sédimentation.
Pour que ces forces de pesanteur soient réduites, la masse de particules en solution (ion,
molécules, macromolécules) doit être faible.
D'après la nature des solutés, on distingue:
- les SOLUTIONS colloïdales: avec des solutés dont la masse molaire est > à 10 000.
- les SOLUTIONS vraies.
Composés hydrophiles
Certains composés ne forment pas de solutions telles que nous les avons définies
auparavant ; ils forment un état dispersé, hétérogène appelée suspension.
Ex : suspension bactérienne, amidon
Ces composés fixent l'eau en quantité parfois importante.
Parmi ces composés, un certain nombre possède une structure macromoléculaire
fibreuse qui peut entraîner la formation d'un réseau tridimensionnel.
Exemples de gel:
<="" -="" en="" microbiologie="" (eau="" +="" agar="" polyoside):="" milieu=""
de="" culture
- gels analytiques: électrophorèse (gel d'agarose), chromatographie
- substance interstitiel du tissu conjonctif.
Composés hydrophobes
Certains composés présentent une répulsion vis à vis de l'eau, ils sont hydrophobes.
La structure de tels composés fait apparaître un nombre élevé de liaisons hydrophobes
et l'absence presque totale de groupements polaires.
Exemple de composés hydrophobes: acides gras.
Expérience: on met 3 gouttes d'huile dans un verre d'eau. Que se passe-t-il ?
Les molécules de lipides se regroupent pour former une seule goutte, et s'orientent de
façon à présenter le minimum de contact avec le solvant aqueux. Il y a formation d'une
goutte unique.
2. Les ions et les sels minéraux
Les sels minéraux constituent ce que l'on obtient après incinération à haute température
(> 500°C) de la matière vivante. Dans un organisme, les principaux sels minéraux
correspondent aux combinaisons des cations et anions suivants:
- cations: Ca2+, Mg2+, Na+, K+
- anions: Cl-, HCO3-, SO42-
Sels minéraux à l'état solide

Sous forme solide, les sels minéraux ne sont pas ionisés, mais ils sont en équilibre avec
leurs ions correspondant en solution.
Sels minéraux en solution
Leur répartition intra et extra cellulaire est indiqué dans l'ionogramme.
1 équivalent (1 Eq) = masse atomique de l'ion / valence de l'ion
Propriétés des solutions
Parmi les nombreuses propriétés des solutions, 3 sont particulièrement importantes
dans le domaine de la biochimie et de la biologie : La pression osmotique / la force
ionique / le pouvoir tampon
La force ionique
La force ionique d'une solution dépend:
– de la concentration
– de l'électrovalence des ions
I = ½ x Σ Ci x Zi²
C'est un paramètre important à prendre en compte car elle influe sur la solubilité des
protéines.
Exemple: calculer la force ionique d'une solution de NaCl à 0.01 mol/L ; d'une solution
de CaCl2 à 0,001mol/L.
Le pouvoir tampon
Un système tampon est constitué par un couple acide-base qui permet d'éviter les
modifications importantes de pH dans l'organisme.
Un des ces systèmes est constitué par l'acide orthophosphorique.
Le phosphore des milieux biologiques tels que le sang et urine est sous forme de sels de
l'acide orthophosphorique H3PO4, triacide ayant comme pKa 1,92; 6,82; 11,7.
1) Ecrire les 3 couples acide-base présents lors des dissociations acides de l'acide
orthophosphorique; nommer ces diverses formes ioniques; indiquer en fonction du pH,
quelles sont les formes majoritaires.
2) Application : Sachant que le sang a un pH de 7,35 et l'urine un pH voisin de 6
indiquer les formes ioniques présentes. Représenter la courbe donnant le pourcentage
des différentes formes ioniques en fonction du pH. Sachant que la phosphorémie est de 1
mmol/L, calculer la concentration des différentes formes ioniques présentes dans ce
sérum à pH = 7,35.
La pression osmotique
Calculer les pressions osmotiques exercées, à 25°C, par les solutions suivantes:
Glucose à 1g/L --> M = 180 g/mol
NaCl à 9g/dm3 --> M = 58,5 g/mol
Urée à 0,2 g/dm3 --> M = 60 g/mol
TD eau et régulation osmotique
Molarité, molalité, concentration osmotique, concentration ionique

A - Donner la définition de la molarité d'une solution.
Calculer la molarité d'une solution aqueuse contenant 585 mg de NaCl par litre d'eau.
Na: PM = 23; Cl: PM = 35,45).
Quelle est la différence entre molarité et molalité ?
Qu'est-ce l'osmolarité d'une solution? Calculer l'osmolarité de la solution précédente, en
admettant que la totalité du NaCl est sous forme ionisée.
En réalité, le coefficient osmotique (O) du NaCl est de 0,93. Quelle la valeur réelle de
l'osmolarité de la solution précédente?
Qu'est que la concentration ionique d'une solution ? En quelle unité s'exprime-telle?
Calculer la concentration ionique de la solution précédente.
On dispose maintenant d'une solution contenant 952 mg de MgCl2 par litre.
Calculer l'osmolarité de la solution, sachant que le coefficient osmotique (0) du MgCl2,
est de 0,89. (Mg : PM = 24,32)
On rajoute à la solution de MgCl2, 600 mg d'urée (PM = 60).
La concentration ionique est-elle modifiée? L'osmolarité est-elle modifiée? Si les valeurs
sont modifiées, calculer les nouvelles.
B - On place la solution précédente de NaCl dans le compartiment de gauche
(compartiment A) du récipient représenté ci-dessous. Le compartiment de droite
(compartiment B), qui contient uniquement de l'eau, est séparé de l'autre par une
membrane perméable à l'eau mais imperméable aux ions.
Dans quel sens le flux d'eau va-t-il se faire? Pourquoi? Comment appelle-t-on ce
mouvement d'eau?
Qu'est ce que la pression osmotique?
En appliquant la loi de van't Hoff, déterminer la valeur de la pression osmotique de la
solution (on prendra R = 8,314 et T = 310 K).
Si on exerce sur le piston du compartiment A une pression P égale a la pression
osmotique, dans quel sens se fera le mouvement d'eau?
Si la pression P exercée sur le piston est supérieure à la pression osmotique, dans quel
sens se fera le mouvement d'eau?
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%