Parcours d`intégration des tests diagnostiques en soins de

Parcours d’intégration des tests
diagnostiques en soins de santé
personnalisés au Québec
Accueillir la médecine de demain
Octobre 2015

v.5 – 17 septembre 2015
1
TESTS DIAGNOSTIQUES EN SOINS DE SANTÉ PERSONNALISÉS AU
QUÉBEC : ACCUEILLIR LA MÉDECINE DE DEMAIN
Table des matières
1. Sommaire exécutif ................................................................................................. 2
2. Les soins de santé personnalisés (SSP) : quand le potentiel devient réalité ... 6
3. Les outils diagnostiques en SSP, pourquoi s’y intéresser? .............................. 8
4. Les tests diagnostiques en SSP : quelques éléments de contexte ................... 9
5. Le parcours d’intégration des tests diagnostiques en SSP ............................. 11
5.1 La recherche et le développement .............................................................. 11
5.2 Le processus d’homologation ..................................................................... 14
5.3 Le processus d’évaluation ........................................................................... 15
5.4 Le remboursement et l’adoption par le système de santé ........................ 19
6. Illustration graphique du parcours d’intégration .............................................. 25
6.1 Parcours d’intégration d’un test diagnostique en soins de santé
personnalisés développé selon une technique maison ....................................... 26
6.2 Parcours d’intégration d’un test diagnostique en soins de santé
personnalisés développé par une entreprise ou un laboratoire privé ................ 27
6.3 Parcours d’intégration d’un test diagnostique en soins de santé
personnalisés non disponible au Québec ............................................................. 28
7. Conclusion............................................................................................................ 29
Annexe A : Entretiens ciblés ...................................................................................... 32

v.5 – 17 septembre 2015
2
1. Sommaire exécutif
Quelques années après avoir été annoncée, l’ère des soins de santé personnalisés (SSP)
semble enfin prendre son envol avec l’arrivée d’applications tangibles. En prônant l’approche de
la meilleure thérapie possible, au meilleur dosage, pour un patient particulier au bon moment,
les applications en SSP ont permis de mieux identifier les patients répondants à une thérapie, et,
en conséquence, améliorer l’efficacité et amoindrir les risques de toxicité, mais aussi favoriser
une prise en charge précoce de certaines maladies. La médecine personnalisée a également
permis d’augmenter les taux de succès de la recherche et du développement, raccourcissant la
durée de développement et diminuant le taux d’attrition de médicaments. La contribution
systémique des SSP réside dans l’utilisation plus efficiente des ressources de plus en plus
limitées des systèmes de santé.
La médecine personnalisée est, très souvent, issue de la combinaison d'un produit
pharmaceutique, un dispositif médical ou une intervention à un diagnostic moléculaire. Les tests
diagnostiques en SSP sont des outils qui, au moyen du dosage de biomarqueurs à l’aide du
profilage moléculaire, déterminent s’il existe des mutations dans le génome ou des protéines
qui pourraient avoir un impact sur la prise en charge préventive, thérapeutique ou
pharmacologique d’un patient. Les tests compagnons conditionnent la propension à tolérer, à
répondre ou non à une thérapie médicamenteuse. En optimisant la prise en charge des patients,
les tests diagnostiques orientent l’utilisation des ressources publiques, mais aussi privées et
bénéficient à l’ensemble de l’écosystème des sciences de la vie.
Aujourd’hui, les tests diagnostiques influencent près de 70 % des prises de décisions.
1
Ils
constituent la pierre angulaire de la transformation d’une médecine réactive à une médecine
préventive. Cependant leur intégration et déploiement dans le système de santé ne semble pas
gagné d’avance. Au moyen de plusieurs entretiens, le Regroupement en soins de santé
personnalisés du Québec (RSSPQ) a entrepris la tâche de cartographier le parcours
d’intégration des tests diagnostiques dans la perspective d’optimiser leur intégration et leur
utilisation par tous les acteurs du système de santé et de maximiser leur plus-value.
Le présent document se veut un outil pour permettre aux nombreux intervenants, notamment
les compagnies productrices de tests diagnostiques, de mieux naviguer un parcours complexe,
mais aussi à faire progresser les réflexions des acteurs économiques et gouvernementaux sur
l’introduction des SSP dans le système de santé. Les défis et enjeux qui entourent l’adoption
des SSP par le réseau de la santé sont également cernés afin de pouvoir éventuellement
identifier de pistes de solutions pour y remédier.
Le parcours d’intégration des tests diagnostiques en SSP
L’intégration des tests diagnostiques dans la pratique clinique implique une séquence complexe
d'évènements et opérations qui lient la recherche et le développement aux processus
d’homologation et d’évaluation et aux stratégies de fixation de prix, d’accès au marché et,
finalement, de remboursement par des acteurs privés ou publics.
1
Roche (2015), Promouvoir la médecine de précision au Canada, Document de réflexion sur les traitements ciblés.

v.5 – 17 septembre 2015
3
La recherche et le développement : le Québec dispose d’une expertise de recherche
clinique et translationnelle en génomique de calibre mondial, des plateformes
technologiques de premier plan ainsi que plusieurs banques de données spécialisées, de
banques administratives et de biobanques importantes. Cet écosystème est soutenu
activement par des organismes de recherche tels que le Fonds de recherche du Québec-
Santé (FRQS), les Instituts de recherche en santé du Canada (IRSC), Génome Québec et
Génome Canada ainsi que les grappes économiques Montréal InVivo, Québec
International et Sherbrooke Innopole.
La recherche et le développement de solutions diagnostiques s’effectuent grâce à des
investissements importants du côté industriel, mais aussi dans les laboratoires publics
provinciaux de profil suprarégional. Ces derniers disposent d’installations de pointe et d’un
personnel hautement qualifié leur permettant de développer des dispositifs in vitro de
diagnostic moléculaire au moyen de techniques dites « maison ».
Le processus d’homologation : Avant de pouvoir être commercialisés au Canada, les
dispositifs de diagnostic in vitro, étant classés dans la catégorie des dispositifs médicaux de
classe III, doivent être homologués par Santé Canada en vertu de la Loi sur les aliments et
drogues. Cette homologation garantit la sécurité et l’efficacité des produits. Il est à noter,
cependant, que le règlement fédéral ne s’applique pas dans le cas où le test a été
développé selon une technique « maison ». Néanmoins, ces derniers sont soumis à des
règles et exigences de validation et de contrôle de qualité. De la même manière, il n’existe
aucun mécanisme permettant une homologation conjointe d’un produit thérapeutique et de
son diagnostic compagnon.
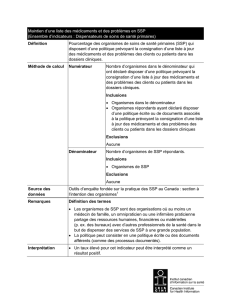
Le processus d’évaluation : Depuis 2013, à la demande de la Direction de la biovigilance
et de la biologie médicale du Ministère de la Santé et des Services sociaux (MSSS), le
Service d’évaluation des analyses biomédicales (SEVAB) de l’Institut national d’excellence
en santé et en services sociaux (INESSS) évalue les analyses biomédicales en vue de la
mise à jour du Répertoire québécois et système de mesure des procédures de biologie
médicale. Les demandes d’ajout ou de modifications du Répertoire proviennent des
laboratoires hospitaliers producteurs ou du MSSS. Après une première analyse et
hiérarchisation, la Direction de la biovigilance et de la biologie médicale achemine les
demandes à l’INESSS trois fois par année. Soutenu par un Comité scientifique permanent
et des experts externes, l’INESSS évalue les analyses au regard de leur utilité clinique, leur
performance diagnostique (validité clinique) et capacité technique (validité analytique). Une
attention est également portée aux considérations économiques telles que le coût-efficacité
de la technologie et son impact budgétaire ainsi que des enjeux organisationnels, éthiques,
professionnels, juridiques et sociaux (par exemple, les modalités d’implantation du test)
lorsque les données sont disponibles. Dans un délai de 4 mois, l’Institut transmet au
ministre une recommandation d’introduire, d’introduire conditionnellement, de refuser ou de
réévaluer ultérieurement la technologie à l’étude.
L’arrivée de médicaments novateurs associés à une technologique interpellera de plus en
plus l’INESSS. Les unités d’évaluation des technologies et des modes d’intervention
(UETMI), situées dans les établissements pourraient également être amenées à jouer un
plus grand rôle dans l’évaluation et l’intégration de ces innovations en présence de
particularités locales ou régionales.

v.5 – 17 septembre 2015
4
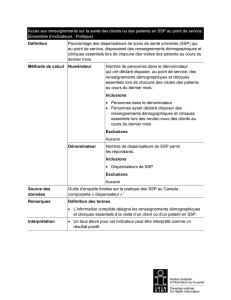
Le remboursement et l’adoption par le système de santé : À la suite de l’évaluation de
l’INESSS, le ministre statue sur l’inscription d’une procédure de biologie médicale au
Répertoire québécois et système de mesure des procédures de biologie médicale qui doit
obligatoirement devenir disponible à toute la population du Québec si un médecin ou une
personne habilitée la prescrit. Le MSSS désigne également un ou plusieurs laboratoires
ayant l’expertise professionnelle requise pour effectuer le test et leur fournit le soutien
requis afin qu’ils soient en mesure d’offrir un service diagnostique de qualité. L’accès aux
tests diagnostiques est le plus souvent établi par l’entremise des processus décisionnels
des hôpitaux et établissements. Tout test diagnostique qu’il soit homologué et commercial
ou développé selon une technique « maison » n’est rendu accessible dans les
établissements que s’il fait l’objet d’une demande explicite par les professionnels de la
santé, médecins, spécialistes et autres professionnels de la santé au MSSS par les
laboratoires hospitaliers. Les laboratoires étant financés par les budgets globaux fixes
affectés à l’établissement, la décision de développer ou introduire des innovations est
tributaire de leur financement propre et requiert la réaffectation de fonds existants, voire
même la réduction de certains types de services ou d’analyses.
Un médecin peut également effectuer une demande pour que son patient ait accès à un
test diagnostique innovant disponible à l’extérieur de la province. Si le test est jugé
pertinent et qu’il est disponible dans une autre province ou un autre pays, le test est financé
par l’établissement désigné et remboursé par la Régie générale de l’assurance maladie du
Québec (RAMQ).
D’autre part, plusieurs assureurs privés ont démontré un intérêt à favoriser l’utilisation de
tests diagnostiques notamment dans une perspective d’usage optimal, pour augmenter le
taux d’adhésion au traitement et, en conséquence, réduire les coûts globaux.
La décision de recourir ou non aux
tests diagnostiques émane de la
perception de l’utilité clinique du test,
l’impact budgétaire anticipé et les
mécanismes d’accompagnement de
l’introduction de ces innovations.
L’adoption par le système de santé
et l’accès aux patients sont
largement facilités lorsque les
processus de remboursement sont
clairs et explicites et lorsque les
différents intervenants dans le
parcours disposent de l’information
la plus complète de la plus-value de
l’introduction de ces innovations,
leurs impacts, mais aussi les risques
et facteurs limitants
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
1
/
34
100%