Cours n°9 Circuit électrique dans l`ARQS

Cours n°9 Circuit électrique dans l’ARQS
Le monde moderne ne serait pas aussi confortable sans l’utilisation du courant électrique ; pensons à tous les
appareils que l’on branche à la maison, machine à laver, réfrigérateur, téléphones et ordinateurs. L’étude de la
conversion électromécanique, « électro-Hertzienne » ou du traitement de l’information commence par celle de la
notion de potentiel électrique, (la différence de potentiel étant la tension, dont vous attendez sans doute qu’on
vous l’explique enfin). On va ici tenter de comprendre comment l’énergie peut être véhiculée par des électrons.
On va voir comment se protéger d’une électrocution. On va comprendre que la valeur 1 d’un bit est l’état passant
d’un transistor ; vous lirez pour cela le document DEL et phototransistor, où le principe du transistor et du
phototransistor sont expliqués ainsi qu’un exemple simple de circuit avec capteur.
Dans un modèle microscopique unidimensionnel d’électrolyte,
on décrit la nature du courant qui est la réponse à un champ électrique
ou à une variation du potentiel.
On aboutit à la loi d’Ohm locale et à la loi d’Ohm macroscopique.
Les lois de nœuds et de maille nécessaires pour résoudre les courants
de branche dans les circuits, sont discutées dans des cas simples.
On donne ensuite la notion de caractéristique d’un dipôle i fonction de u associée à une convention récepteur ou
générateur. On compare aussi les sources de courant et de tension idéales et réelles. Enfin on établit le lien
entre la puissance électrique reçue par les dipôles et la puissance mécanique reçu par les porteurs de charges
I) Charge, intensité
1) Charge
- Force d’interaction de Coulomb entre deux charges
9
12
12
1 2 2 1
00
19 10
4 ² 4
u
qq
FF
r
obéit au principe d’action réaction
Si les deux charges ont même signe, on a une force répulsive. Si elles ont des signes opposés c’est
une force attractive.
Expérience historique : Balance de torsion de Coulomb qui prouve l’interaction en 1/r² 1785
- 1881 Thomson découvre l’électron et donne la mesure de e/m
- 1834 Faraday : lois de l’électrolyse
La quantité de substance libérée lors d’une électrolyse à une électrode est proportionnelle au temps et au
courant électrique (ce qui équivaut à la charge)…
- 1908 Millikan quantification de la charge qui est un multiple entier de la charge de l’électron
q(électron) = -1.6 10-19 Coulomb
- 1909 expérience de Rutherford atome noyau : Z protons , A-Z neutrons , Z électrons
La charge est conservative : la charge d’un système isolé ne varie pas dans le temps.
Par exemple, la création d’une paire électron positron ne fait pas varier la charge globale

La charge est une grandeur additive ; si deux sphères porteuses respectivement des charges q1 et q2
sont mises en contact la charge globale est q1+q2
2) Intensité
Conducteurs
- Métaux et alliages métalliques avec électrons libres ou électrons de conduction
- Electrolytes avec cations et anions
- Semi-conducteurs ; électrons promus thermiquement dans la bande de conduction et trous laissés par le
départ des électrons dans la bande de valence
Un courant électrique est un déplacement de charges.
Définition de l’intensité qui caractérise un courant électrique
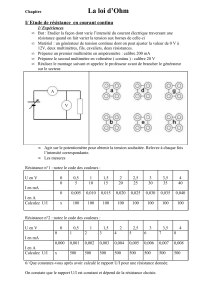
Pour définir l’intensité, on a besoin d’une section d’aire S orientée par sa normale ici de gauche à droite.
Si une charge dq passe pendant le temps dt par la section d’aire S orientée dans la direction
N
, on veut dire que la
charge traverse la section dans le sens de
N
entre les dates t et t+dt, alors le courant mesuré dans le sens de
N
est
dq
Idt
Si une charge dq’ passe par la section dans le sens –
N
pendant dt alors le courant I mesuré dans le sens de
N
est
'dq
Idt
Si pendant dt une charge dq passe de gauche à droite et que pendant le même temps une charge dq’ passe de droite
à gauche alors le courant mesuré dans le sens de
N
est
'dq dq
Idt
L’unité du courant est l’Ampère
1 1 /A C s
N
I

3) Intensité dans un électrolyte, Loi d’Ohm locale et loi d’Ohm macroscopique
Cette démonstration sera reprise dans le cours de deuxième année,
Raisonnons sur une ampoule cylindrique d’électrolyte polarisé par un champ électrique uniforme E
Les cations ont pour charge q+= + z+ e, ils sont en nombre n+ par unité de volume
Les anions ont pour charge q-= - z- e, ils sont en nombre n- par unité de volume
L’électro-neutralité de l’électrolyte impose la contrainte n+q++n-q-=0 entre les paramètres n+,q+,n- et q-
I=I++I- avec
I+ la contribution des cations au courant mesurée dans le sens de
N
de la gauche vers la droite,
et I- est la contribution au courant des anions mesurée dans le sens de
N
de la gauche vers la droite toujours.
E
F q E
A
B
F q E
N
S
Pile de
f.e .m e
UAB = e=VA-VB
I

Ecrivons la Relation Fondamentale de la dynamique pour un cation :
en régime permanent 0
dv q E
m q E v q E v v
dt
+ prononcer èta + est le coefficient de viscosité associé au déplacement des cations dans le fluide .
Une force de frottement s’oppose au mouvement d’où le -.
Les cations qui passent à travers la section de surface S entre t et t+ dt sont contenus dans un cylindre de longueur
v+dt et de base S soit un volume dV+= v+dt, ils sont au nombre de n+ dV+ et la charge dq+ due aux cations qui passent
à travers la section est dq+= q+n+ dV+= q+n+ S dt v+
²q E q n dt
dq q n Sdt S E
L’intensité du courant de cation I+ est alors
²dq q n
I S E
dt
On définit alors la densité volumique de courant associée aux cations j+ telle que I+=S j+
²qn
jE
j+ est proportionnelle au champ électrique, la constante de proportionnalité est notée + et est appelée conductivité
associée aux cations
²qn pour que j E
Intéressons nous maintenant aux anions :
-
en régime permanent 0
la vitesse est dans le sens droite vers gauche car q <0
qE
q E v v
Les anions qui passent à travers S entre t et t+dt passent de droite à gauche et sont contenus dans le cylindre de
volume dV- = S v-dt qui contient la charge dq- = dq’ = n- q- S v-dt < 0
N
v+dt
v-dt
N
I
I

Comme ces charges passent de droite à gauche la contribution au courant mesuré de gauche à droite est
I-=-dq’/dt= -n- q- S v-dt = n- q- S v- puisque v-<0
²0
dq q n
I q n S v S E
dt
²²
² ² ² ²
q n q n
I I I S E S E
q n q n q n q n
jE
Les cations et les anions qui portent des charges de signe opposés mais se déplacent dans des sens différents
contribuent tous deux à un courant dans le même sens.
j = E est la loi d‘ohm locale, elle est vraie en un point du milieu et établit une relation entre variables dites
intensives ( c’est à dire ne dépendant pas de la quantité de matière considérée)
3) Ordres de grandeur des intensités
1fA : ordre de grandeur du courant minimal mesurable par un électromètre de laboratoire.
100 pA : ordre de grandeur du courant minimal mesurable par un multimètre commercial.
2 µA : montre à cristaux liquides2. influx nerveux 20 A
1 mA : prothèse auditive intra-auriculaire3. Courant létal 20mA
0.5A : ampoule 100W de l’ordre de 100/220=0.5A
5A : radiateur 1000W 5A
16 A : courant maximal dans une prise électrique standard d'Europe continentale.
20A : plaque cuisson
500 A : courant maximal typique d'une batterie automobile au plomb.
630A : le record a été établi en 2007 avec un TGV de puissance de traction de 19,5MW donc un peut plus en
puissance absorbé (électrique) pour une tension de catétaire de 31kV pour limité le courant dans la catétaire au
alentour de 630A qui aurai été plus élevé avec une tension catétaire de 25kV qui est la tension "normales"
871 A : courant maximal d'un câble haute tension A enterré (section de conducteur 10 cm2).
50kA : éclair
fin du cours mardi 4 novembre
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
1
/
22
100%