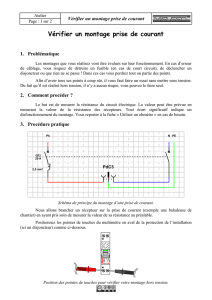
3-Biologie cellulaire du 30 janvier

1
Biologie cellulaire : 3ème cours Peltier du 30 janvier
Les récepteurs membranaires.
Définition :
-Ligant : Désigne une molécule capable de reconnaître spécifiquement une autre molécule ou
édifice moléculaire et de s’y fixer. C’est le médiateur soluble
-Récepteur : Toute protéine à laquelle s’attache les molécules de signalisation et qui
provoque une réponse cellulaire. C’est en général un édifice moléculaire.
-Effecteur primaire : c’est une enzyme situé dans la membrane ou à proximité, dont la
fonction va être activé par le récepteur et qui conduit à la production d’un second messager.
L’exemple est l’adénylate cyclase.
-Seconde messager : molécule de signalisation intracellulaire dont la concentration augmente
ou diminue très rapidement suite à l’activation d’un récepteur. Exemple : AMPc, calcium,
DAG, IP3. Un second messager est produit rapidement et dégradé rapidement ou recapter afin
que le signal qu’il porte disparaisse rapidement.
-Effecteur secondaire : est un système enzymatique mis en jeux par le second messager.
On définit donc le mécanisme de transduction du signal qui est la conversion d’un message
extracellulaire en message intracellulaire et qui comprends les étapes concernant le ligant, le
récepteur et l’effecteur primaire.
Le récepteur est une notion ancienne de 1910 avec Erlich qui a postulé que « pour
qu’une substance agisse, elle doit se fixer ». Il y a pourtant une exception : c’est le NO dont
on verra qu’il agit directement sur une enzyme intracellulaire sans s’y fixer, c’est une simple
interaction. On considère que ce postula est vrai.
C’est l’expression d’un récepteur qui va conditionner la sensibilité d’une cellule à une
molécule de signalisation. Ces récepteurs membranaires sont des protéines membranaires
intrinsèques. Leurs structure est quasiment constante avec 3 domaines :
- Un extracellulaire : est hydrophile et glycosylée, qui correspond au site de reconnaissance et
de fixation du ligant.
- Un transmembranaire : il est hydrophobe car constitué d’AA hydrophobe.
- Un intracellulaire : C’est un domaine fonctionnel qui donne naissance au signal
intracellulaire.
En réalité, les récepteurs fonctionnent souvent groupés en multimère d’unités identiques ou
différentes.
La liaison du ligant à son récepteur n’est pas covalente. Elle se fait grâce à des liaisons
d’énergie faible c’est à toute liaison qui n’est pas covalente. Ces liaisons sont en grand
nombre et il peut y avoir une fixation assez forte. Le fait que ce soit des liaisons faibles et
notamment ioniques vont faire qu’elles sont sensibles à l’environnement et notamment au PH
et à la force ionique qui peut stabiliser ou déstabiliser cette interaction
-Cette interaction est réversible et à l’équilibre de cette réaction la vitesse d’association est
égale à celle de dissociation du complexe ligant récepteur et la proportion des formes liées et
libres dépends de l’affinité du récepteur. En règle générale, les récepteurs ont une forte
affinité pour leur ligant donc c’est surtout sous forme lié que ces éléments existent. On utilise
la constante de dissociation Kd pour relater cette affinité. Le Kd est en molaire, c’est la
concentration pour laquelle la moitié des sites va être occupé. Plus le Kd est faible plus
l’affinité est forte. En règle général il est de 10-8 molaire ce qui est proche des concentrations
des médiateurs circulant.

2
-Spécificité d’un récepteur : capacité du récepteur à distinguer des molécules proches.
Exemple de l’insuline et IGF-1 qui sont deux ligants du récepteur à l’insuline, qui vont tous
les deux activer ce récepteur donc on peut pas dire que le récepteur à l’insuline est spécifique
de l’insuline car il lit d’autres molécules naturelles.
-Il y a un nombre finit de récepteurs à la surface de cellule donc il y a une capacité de fixation
à la surface de cellule.
-Quand il y a communication via un signal extracellulaire, ça active le récepteur, il y a des
relais intracellulaires qui vont amplifier le signal et se répartir sur différents sites des activités
métaboliques, de l’expression de gènes ou la modification du cytosquelette pour changer la
forme ou l’adhérence de la cellule.
Comment ce signal extracellulaire passe dans le domaine intracellulaire ?
2 modèles :
1- Modèle allostérique : inventer en premier. On imagine qu’un ligant va se fixer à son
récepteur, cette fixation induit un changement de conformation du récepteur qui va se
propager jusque dans le domaine intracellulaire et celui ci acquière alors des nouvelles
fonctions : enzymatiques ou de l’affinité pour d’autres molécules intracellulaires. Le
problème c’est qu’entre les deux domaines extra et intracellulaires il y a un transmembranaire
qui est une séquence hydrophobe figé très compacte et il est difficile d’imaginer que ce
domaine puisse changer et transmettre un changement de conformation d’un domaine à un
autre.
2- Modèle de la coopération : Le récepteur du VEGF est activé quand il est en dimère car les
deux domaines intracellulaires en relation forme l’activation. Le VEGF circule sous le forme
de dimère donc il est facile d’imaginer que ce dimère va s’associer à deux unités de
récepteurs, les regrouper et ainsi les récepteurs regroupés seront activés. On peut démontrer ce
modèle si on utilise un anticorps anti VEGF-R dont chaque bras va lié un récepteur sans pour
autant l’activer (rien avoir avec la fixation du ligant) mais ça permet un pontage entre deux
récepteurs et le message du VEGF va passer à ce moment là sans VEGF donc le
rapprochement de deux récepteurs est ici responsable de l’activation. Beaucoup de molécules
circulent de façon unitaire donc on peut imaginer que le ligant se lit à la partie extracellulaire,
modifie sa conformation de sorte que cette partie extracellulaire va avoir une affinité
importante pour les autres récepteurs de même type et c’est à cause du domaine
extracellulaire que les récepteurs vont se lier ce qui associe les parties intracellulaires et faire
naître le signal intracellulaire. Dans tout les cas c’est le rapprochement des domaines
intracellulaires qui est responsable de l’activation.
Ces deux modèles ne sont pas exclusifs : dans la plupart des cas la vérité est entre les deux,
les modèles sont mixtes.
Mise en évidence de la présence de récepteurs sur cellule
On prends une culture de cellule, on utilise un ligant qu’on marque en radioactif. On incube
ce ligant marqué sur les cellules, retirer ensuite cette suspension de ligant, faire des lavages
pour conserver ce qui est spécifique (forte affinité) et ensuite on mesure la radioactivité qui
reste fixer à la surface des cellules donc on met en évidence qu’il y a ou non fixation du ligant
aux cellules et qu’il y a ou non des récepteurs.
Capacité de liaison :
On mesure la radioactivité donc la quantité de ligant lié à la surface des cellules en fonction
de la quantité de ligant marqué ajouté. A partir d’un certain moment il y a un plateau donc on
a saturé les sites potentiel de fixation du ligant. On peut donc déterminer le nombre de site

3
qu’il y a à la surface de cette population cellulaire ou d’une cellule. En général il y a entre 104
et 106 récepteurs par cellule pour une cellule qui réponds à un ligant.
Si la fixation était aspécifique, on aurait jamais de plateau : le ligant que l’on met se fixe
n’importe où.
Spécificité de liaison :
On prends la condition précédente : on attends que la plateau soit atteint donc on a saturé les
sites de fixation au niveau des cellules et maintenant on rajoute un compétiteur : un autre
ligant dont on veut tester s’il se fixe au récepteur mais celui ci ne sera pas marqué : froid.
-1er cas : Ca ne change pas la radioactivité donc ce compétiteur ne s’est pas mis du tout à la
place de l’autre, il a laissé le ligant marqué lié donc il n’a pas d’affinité pour le récepteur (ou
inversement). En d’autre terme ici le récepteur est spécifique du ligant marqué vis à vis du
compétiteur 1.
-2ème cas : Un deuxième compétiteur est ajouté, ça diminue un peu la radioactivité à la surface
de cellule donc il s’est mis un peu à la place du ligant marqué donc que le récepteur n’est plus
tout à fait spécifique d’un ligant par rapport à l’autre.
-3ème cas : Ce compétiteur supprime complètement la radioactivité donc il prends la place de
toutes les molécules qui étaient marquées et liées aux récepteurs. Donc le récepteur n’est pas
spécifique du ligant marqué vis à vis de ce C3 mais surtout sans doute que ce compétiteur a
une plus forte affinité que l’autre, l’a chassé complètement.
Est ce que tout ligant active le récepteur ? Non.
1- Ligant agoniste : Se fixe au récepteur, change la conformation : l’active et induit un signal
intracellulaire.
2- Ligant antagoniste : Se fixe au même site mais n’induit aucun changement de
conformation du récepteur donc aucun signal intracellulaire. On pourrait dire qu’il n’a aucun
effet mais c’est faux car il empêche le ligant agoniste de ce fixer donc il diminue la réponse
de l’agoniste.
-Les antagonistes compétitifs :
-les antihistaminiques : l’histamine est un médiateur de l’inflammation impliqué dans
l’allergie. Les anti histaminiques sont des antagonistes compétitifs de l’histamine donc
prennent la place de l’histamine au niveau du récepteur et n’induire aucun effet donc diminuer
l’effet de l’histamine au niveau de l’inflammation et l’allergie. Si on prends des
antihistaminiques, il y a un effet secondaire de somnolence donc il faudrait pouvoir dissocier
les deux effets et pour cela on essai de comprendre quels sont les récepteurs mis en cause
puisqu’il y a 3 types de récepteurs : H1, H2, H3 qui sont exprimés en différents sites de
l’organisme et peut être qu’on peut dissocier la somnolence de l’antiallergie donc il faudra
trouver un antagoniste spécifique de l’effet inflammatoire.
-Bêta bloquants : Antagoniste compétitif du récepteur bêta adrénergique utilisé dans les
troubles cardio vasculaires, d’hypertension ou du rythme.
Pour mieux visualiser ces antagonistes : Voici le récepteur cholinergique nicotinique. Il y
a plusieurs antagonistes pour ce récepteur :
-le curare et l’alpha bungarotoxine qui sont des antagonistes compétitifs c’est à dire qu’ils se
mettent au même site que l’acétylcholine qui est le ligant naturel et empêcher sa fixation donc
ils se mettent ici sur les deux sous unités alpha.
-Antagonistes non compétitifs : la tétracaine et proadifen qui se mettent dans d’autres sites
sans interaction avec l’acétylcholine. Puisque ce récepteur est un canal, si le proadifen se met
dans le canal ça bloque le canal donc l’effet de ce récepteur et l’Ach peut encore venir se fixer
mais n’aura aucune fonction.

4
Effet biologique :
-Exemple 1 : Effet du FGF sur le FGF-R3. Le FGF-R3 est exprimé sur les cellules
épithéliales ou des cellules de la lignée hématopoïétique B et d’autres part des chondrocytes
responsables de l’expansion des os longs. Donc le point commun est un même facteur, le
même récepteur, 2 groupes cellulaires différents. Lorsque FGF se fixe au récepteur, les effets
sont opposés puisque dans un cas on augmente la prolifération, dans l’autre on la diminue. Il
existe des mutations de ce récepteur qui sont activatrices constitutives ce qui veut dire que le
récepteur se retrouve sous forme activé en permanence même s’il n’y a pas de ligant. Ce qui
veut dire que dans un cas la prolifération va être augmenté en permanence, dans l’autre cas
elle sera diminué en permanence. Dans le 1er cas, si c’est une mutation acquise au cours du
temps ça peut déboucher sur un phénomène de cancérisation car cycle cellulaire dérégulé. Si
la mutation est congénital, il y a une hypoplasie, un défaut de croissance des os long donc un
anisme donc ici une hypochondroplasie pour la forme légère jusqu’au nanisme thanatophore
c’est à dire létal. Donc avec le même facteur, même récepteur on peut avoir effet opposé.
-Exemple 2 : Le VEGF est une famille de 4 facteur de A à D et il y a 4 récepteurs de 1 à 4.
Toutes les combinaisons ne sont pas possibles : Le VEGF-A va se fixer et activer VEGF-R1
et VEGF-R2 à la surface des cellules endothéliales (plusieurs récepteurs pour le même ligant).
Le VEGF-B ne peut se fixer qu’au VEGF-R2 et va l’activer. On montre donc qu’il peut y
avoir plusieurs ligants pour un seul récepteur. Est-ce utile d’avoir deux facteurs se fixant sur
le même récepteur, d’avoir un facteur se fixant sur 2 récepteur ? Les deux récepteurs vont
médier des signaux différents : Le VEGF-R1 va plutôt activer la migration des cellules
endothéliales lors de l’angiogénèse et le VEGF-R2 plutôt la prolifération des cellules
endothéliales. Pour les VEGF, ils ne sont pas synthétisés par les mêmes cellules, pas
simultanément et ils ne circulent pas aux mêmes concentrations. Donc ils ont des effets
réellement différents : ce système est complexe.
Le récepteur à la surface des cellules endothéliales impliqué aussi dans l’angiogénèse : c’est
le récepteur Tie-2 dont les ligants sont les angiopoiétines. Ce système Tie-2 et angiopoiétine
est responsable des interactions des cellules endothéliales avec la MEC et avec les cellules
musculaires lisses dans les phases tardives de l’angiogénèse c’est à dire la maturation des
vaisseaux. Donc ce système est plutôt là pour activer l’angiogénèse, celui ci est plutôt là pour
l’éteindre et c’est aussi important.
L’angiopoiétine 1 se fixe et active le récepteur, elle va donner un message de survie cellulaire
aux cellules endothéliales. Il existe un antagoniste compétitif naturel du récepteur Tie-2 :
l’angiopoiétine3 qui va aussi ce fixer à ce récepteur, ne pas l’activer mais bloquer l’effet de
l’angiopoiétine 1 et donc au final faire pencher la balance vers la mort cellulaire.
L’angiopoiétine 2 peut médier l’un ou l’autre : Ce n’est pas au hasard, ça dépends du VEGF.
L’ang-2 va médié la survie cellulaire en présence de VEGF et sera responsable de l’apoptose
des cellules endothéliales en absence de VEGF.
-Conclusion : Un ligant peut se fixer à plusieurs récepteurs, plusieurs ligants sur un seul
récepteur, un ligant sur un récepteur peut avoir différents effets sur différentes cellules donc
au final pour comprendre une réponse logique il faut définir tous les paramètres c’est à dire le
ligant, le récepteur, le type cellulaire et peut être plus comme avec Tie et VEGF-R.
Purification des récepteurs
Essentiel à leurs compréhension, c’est difficile à faire car ce sont des protéines rares de faible
densité à la surface des cellules et elles sont enchâssées dans la membrane donc si on veut les
récupérer il faut utiliser des détergents pour les retirer de la membrane. 3 techniques de
purification. Toutes ces techniques nécessite de connaître et de détenir le ligant
correspondant.

5
1- Marquage d’affinité
Le récepteur et le ligant sont des protéines donc groupement amine à la surface de ces
composés. Il existe des réactifs de pontage comme NHS qui sont des molécules qui font un
pont entre 2 amines voisines. Donc si on incube une culture cellulaire qui exprime le
récepteur avec le ligant correspondant qui est marqué, qu’ensuite on fait agir ce réactif de
pontage on va associé de façon covalente les deux composés qui seront donc solidaire par la
suite donc on a fait un marquage radioactif du récepteur de façon intermédiaire. A partir de là,
on peut faire des études, lyser les cellules, récupérer toutes les protéines, faire une
électrophorèse et visualiser le complexe ligant/récepteur qui sera visualisable grâce à la
radioactivité du ligant donc on pourra déterminer la masse du récepteur, le purifier, l’extraire
du gel d’électrophorèse donc on aura purifié ce complexe.
2- Chromatographie d’affinité
Des colonnes de chromatographies avec un gel à l’intérieur qui contient des billes, à la surface
de ces billes on a attaché par covalence le ligant du récepteur que l’on recherche. Sur cette
colonne on va faire passer un extrait cellulaire contenant potentiellement le récepteur qui
correspond au ligant. Donc ce récepteur va se lier au ligant dans la colonne, ensuite on fait des
lavages pour qu’il ne reste plus que cette association qui est spécifique et assez forte. Enfin on
va éluer c’est à dire décrocher le récepteur par 2 techniques :
- Rajouter une solution de ligant qui va rentrer en compétition avec celui immobiliser sur la
colonne et au passage ce ligant diffusible libre va emmener avec lui le récepteur qui était
accroché donc on aura au fond des tubes le récepteur + son ligant.
- Cette interaction est sensibles à l’environnement donc on peut faire un saut de PH : diminuer
le PH par exemple à 2,5 acide qui va déstabiliser cette interaction donc le récepteur descendra,
sera éluer seul cette fois ci donc le récepteur aura été réellement purifié.
Cette technique est applicable dès que deux protéines ont une affinité l’une pour l’autre.
3- Clonage par expression
Il nous faut 2 types cellulaires : un qui exprime à coup sur le récepteur et l’autre qui ne
l’exprime pas. La cellule qui exprime le récepteur exprime la protéine mais avant cela elle
exprime l’ARNm et c’est celui ci qu’on va aller rechercher. Donc on va extraire les ARNm de
cette cellule, on fait une rétro transcription pour avoir de l’ADNc qui est beaucoup plus stable
(plus facile de travailler avec de l’ADNc). Donc ici on a tous les ADNc correspondant à tous
les ARNm exprimés par la cellule. Chaque ADNc individuellement va être mis dans un
vecteur : un plasmide. L’ensemble de ces plasmides constitue une banque d’expression. Ces
plasmides sont mis dans des bactéries afin d’amplifier la quantité de matériel. Donc chaque
clone bactérien contient l’équivalent de l’ADNc de cette cellule d’origine donc pour avoir
tous les ARNm de cette cellule on aura peut être une population de milliers de bactéries
différentes pour représenter tout ce que la cellule peut exprimer. Ensuite on extrait ces ADNc
et on va les injecter dans des cellules qui sont R- (qui n’expriment pas ce récepteur) donc on
aura autant de culture cellulaire qu’on avait de clones bactériens. Et on va faire un criblage
avec le ligant marqué c’est à dire qu’on met en contact ces populations cellulaires avec un
ligant marqué et voir laquelle ne retenait pas et maintenant retient le ligant à sa surface, lequel
exprime le récepteur. Donc celle qu’on aura retenu car elle retient le ligant, on récupère
l’ADNc cloné correspondant au plasmide qu’on a mis à l’intérieur et en déterminer la
séquence.
- Etapes pour purifier, identifier, connaître un récepteur dans les deux 1er techniques:
On fait un micro séquençage de la protéine, on en déduit la séquence en AA donc
possiblement une séquence oligonucléotidique, on fait des sondes, rechercher l’ARNm
correspondant dans les cellules qui expriment le récepteur et à partir de là faire un séquençage
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%