Le modèle de l`atome

DEMOCRITE (460-370 av J.-C.)
Le modèle de l’atome :
Qu’est-ce qu’un modèle scientifique ?
La réalité du monde qui nous entoure est souvent trop complexe pour que l’homme puisse la connaître dans sa
globalité du premier coup. Un modèle est une représentation simplifiée de cette réalité que l’homme est
capable de comprendre compte tenu des connaissances qu’il a acquises au préalable.
Un modèle est considéré comme bon tant qu’il permet d’expliquer ce que nous observons autour de nous, mais
il doit être rejeté ou amélioré si une expérience vient le contredire.
Exemple : Les Chinois, comme d'autres peuples de l'Orient, s’étaient imaginés que
dans le ciel il y avait un dragon, ennemi déclaré du Soleil qu'il voulait dévorer.
Ainsi, lorsque survenait une éclipse de soleil, ils faisaient tous un bruit épouvantable
de tambours et de bidons de cuivre, sur lesquels ils frappaient de toutes leurs forces
jusqu'à ce que le monstre, effrayé par le bruit, ait lâché prise… et cela était efficace !
Le plus ancien mot chinois pour désigner une éclipse, "shih", veut dire "manger".
Questions :
► Comment s’aperçoit-on sur terre qu’il se produit une éclipse de soleil ?
► Quel est le modèle conçu par les chinois dans l’antiquité pour expliquer une éclipse de soleil ?
► Qu’est-ce qui semblait prouver que ce modèle était bon ?
► Comment explique-t-on de nos jours le phénomène d’éclipse solaire ?
De quoi est constituée la matière ?
► Quelle est l’origine du mot « atome » ? De quelle époque date-t-elle ?
► Décrire le modèle de l’atome proposé à cette époque.
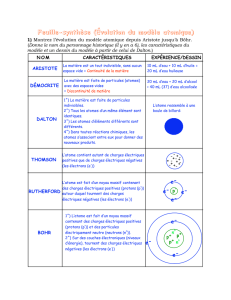
ARISTOTE (384-322 av.J.-C.)
La matière est constituée de particules invisibles à
cause de leur petitesse, mais indivisibles et éternelles.
On les appelle atomes (du grec « atomos » : qu’on ne
peut diviser) et ils ont une forme crochue qui leur
permet de se lier les uns aux autres, assurant ainsi la
cohésion des corps. Entre les atomes, il y a le vide.
Mais non ! on sait tous que la matière est constituée de
quatre éléments : l’eau, la terre, le feu et l’air.
Ceci explique le caractère plus ou moins volatil, chaud,
froid, humide, ou sec de chaque matière, mais elle peut
être divisée à l’infini et le vide n’existe pas.
1

La théorie d’Aristote correspondait davantage aux idées de l’époque que celle de Démocrite, qui n’avait aucune
preuve pour valider le modèle atomique. Celui-ci est donc resté en complet sommeil pendant vingt-deux siècles !
C’est John DALTON (1766-1844) qui la réveille en publiant en 1803 une représentation des atomes
sous forme de sphères pleines incassables ayant des propriétés et des masses différentes.
En s’appuyant sur les travaux d’Antoine Lavoisier qui avait montré en 1777 que lors d’une
transformation chimique : « rien ne se perd, rien ne se crée, tout se transforme », il affirme que les
atomes ne peuvent être ni créés, ni détruits lors de transformations physiques ou chimiques, et que les
atomes d’éléments simples se combinent dans des proportions bien définies pour former de nouveaux produits.
Mais en 1879, William CROOKES montre que l’on peut extraire de la matière
des particules très légères et portant une charge électrique négative, que l’on
appellera par la suite électrons.
Ces électrons apparaissent comme des constituants de la matière, donc constituants
des atomes qui ne peuvent plus alors être considérés comme indivisibles !
► Décrire le modèle de l’atome proposé par J.DALTON, et préciser ce que ce modèle
permettait d’expliquer et pourquoi il a dû être rejeté.
Pour remplacer le modèle précédent, J.J. THOMSON (1856-1940) imagine alors en
1902 un modèle de l’atome ressemblant à un pudding (pâte contenant des raisins secs).
L’atome serait une boule remplie d’une substance chargée positivement dans laquelle des
électrons seraient immergés.
Ernest RUTHERFORD (1871-1937) cherche alors à savoir comment les charges positives et
négatives récemment découvertes sont organisées dans un atome.
En 1911 il réalise une expérience cruciale prouvant que les charges positives ne sont pas réparties
uniformément dans tout le volume d’un atome, mais concentrées en son centre dans un petit « noyau ».
L’expérience de Rutherford :
Une source radioactive au radium émet naturellement des particules
alpha chargées positivement qui sont dirigées vers une feuille d’or
très mince (épaisseur 0,1m).
L’écran fluorescent permet de visualiser l’impact des particules.
Rutherford a constaté que la tache observée sur l’écran n’est presque
pas modifiée par la présence de la feuille d’or : seules quelques rares
particules (1 sur 100000 environ) sont déviées sur les côtés !
Questions :
► Le rayon d’un atome d’or est de 144.10–12m. Combien y a-t-il de
couches d’atomes dans l’épaisseur de la feuille ?
► Pourquoi cette expérience contredit-elle le modèle de Thomson ?
► Sachant que deux particules chargées positivement se repoussent
à distance, comment expliquer la trajectoire de la particules 2 ?
► Quelques rares particules sont renvoyées vers l’arrière. Pourquoi ?
► Quelle analogie vous paraît la meilleure ?
Un joueur de tennis envoie des balles contre un mur
Un enfant jette du sable à travers un grillage à larges mailles
Un chasseur tire des balles à travers une feuille de papier
Le tube de
Crookes
2
1
/
2
100%