R2 - Roneo`07

Immuno – L’auto-immunité – page 16
Gaudex/Cluzel
17/02/09
M&M's
IMMUNO
17h-18h
S.Boullier
La tolérance immunitaire
Définition : Le système immunitaire a appris à faire la différence entre les Ag du soi et du non soi :
c'est la tolérance immunitaire.
1)Cas des LT :
Tolérance centrale :
Au niveau central les LT apprennent la tolérance centrale dans le thymus :
a)au centre :
Les LT sont CD4+ CD8+.
b)en allant vers la périphérie :
Il y a une sélection positive : s'il y a reconnaissance du CMH I, alors le LT sera CD8+, s'il y a
reconnaissance du CMH II, alors le LT sera CD4+, s'il n'y aucun CMH reconnu, alors le LT est
détruit.
c)avant la sortie :
Il y a une sélection négative:
les LT cheminent à travers les cellules présentatrices d'Ag du soi. Celles-ci ayant circulé dans tout
l'organisme pendant la gestation pour récupérer le maximum d'Ag du soi.
Les LT qui ne reconnaissent pas les Ag du soi peuvent sortir du thymus,
Les LT qui reconnaissent des Ag du soi sont éliminés.
Problèmes à ce stade : il est impossible que les cellules présentatrices aient présenté TOUS les Ag
du soi (car certains ne sont exprimés qu'à la puberté par exemple).
Il y a 99% des Ag du soi qui sont contrôlés.
Tolérance
périphéri
que :
Il existe de
nombreux
mécanisme
s dans la
circulation
des LT au
niveau
périphériq
ue pour
éviter que
le 1%
restant ne
pose
problème.
a)séquestr

Immuno – L’auto-immunité – page 26
ation :
Les Ag du soi sont localisés dans des endroits auxquels les LT n'ont pas accès.
b) sites immunologiques privilégiés :
Certains sites privilégiés sont baignés dans des substances anti-inflammatoires. Ces dernières
empêchent l'activation des LT après reconnaissance d'Ag du soi, (yeux, système nerveux central, ou
testicules).
c)mort induite par l'activité continue :
Quand un LT est activé par un Ag du soi, il exprime à sa surface des molécules qui le rendent
sensible à l'attaque par d'autres LT. Il y a donc destruction de ce LT auto -immun.
d)mise au repos et désactivation du LT :
Certaines cellules dendritiques sont présentatrices d'Ag du soi uniquement. Si un LT naïf reconnaît
l'un d'eux, il est « mis au repos », c'est-à-dire qu'il reçoit un signal d'inhibition au lieu du message
habituel d'activation. Le LT rentre dans les nœuds lymphatiques et est désactivé. Il devient ainsi
tolérant, donc sa circulation dans l'organisme est sans danger.
RQ : un tel LT n'a plus aucun rôle car ne reconnaît plus aucun antigène.
e)LT régulateurs :
Il existe des LT régulateurs (notés LT reg ou Th3) qui synthétisent des cytokines anti-
inflammatoires IL10 et TGF bêta. Ils sont systématiquement recrutés si le système immunitaire
atteint un niveau élevé d'activation.
Ils sont chargés de bloquer le développement des maladies auto-immunes, et de limiter les
phénomènes d'hypersensibilité de type I à IV. L'inconvénient est que dans certains cas ils
empêchent l'élimination de certains pathogènes qui nécessiteraient une forte réponse immunitaire.
2)Cas des LB :
Il y a très peu de contrôles des LB à leur sortie de la moelle osseuse, donc de nombreux LB
autoréactifs dans le sang, qui vont subir plus ou moins les mêmes mécanismes que ci-dessus.
Cependant, il faut savoir que pour qu'un LB synthétise des anticorps contre les Ag du soi, il doit
nécessairement être activé par un LT dirigé contre cet Ag, or on vient de voir plus haut que les LT
sont eux rendus tolérants par de nombreux mécanismes.
L'auto immunité.

Immuno – L’auto-immunité – page 36
- 1)Etiologie
Les maladies auto-immunes surviennent lorsque, à un moment ou à un autre, la tolérance est levée.
Mais ce sont toujours des phénomènes multi-factoriels car il existe de nombreux systèmes de
contrôle du système immunitaire (SI), il faut donc nécessairement que plusieurs problèmes
s’accumulent dans l’organisme pour voir apparaître une maladie auto-immune (MAI).
On a ainsi pu identifier plusieurs causes possibles :
a)Rupture de la tolérance périphérique.
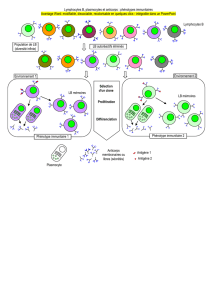
Il s’agit d’un dysfonctionnement des cellules présentatrices d’antigènes (CPA) :
Normalement (cas 1 schéma), les CPA doivent exprimer le CMH de classe I ou II, une
molécule de co-stimulation et produire les cytokines adéquates, elles entraînent alors la stimulation
du lymphocyte T naïf reconnaissant l’antigène présenté.
Si la CPA ne possède pas de molécule de co-stimulation (cas 2 schéma), c’est un signal
d’anergie ou de mort qui est envoyé au LT.
Si ce n’est pas le bon peptide qui est présenté, (cas 3 schéma), le LT reste indifférent car il
n'y a pas de signal émis.
b)Déficit de régulation immunitaire.
Tout dysfonctionnement des LTReg favorise le développement des MAI.
Lors d’une immuno-dépression, même légère, les premiers lymphocytes à ne plus fonctionner sont
ces LTReg, ce qui explique l’apparition fréquente de phénomènes auto-immuns lors des syndromes
d’immuno-dépression (alors que paradoxalement le nombre de lymphocytes diminue !).
Dès qu’on a une mauvaise orientation de la réponse Th-1 par rapport à la Th-2 (et
inversement), les cytokines produites favorisent également le développement d’une MAI.
c)modification de la synthèse ou de la présentation d’antigènes du soi.
Toute infection due à un agent pathogène cytopathologique induisant une destruction
cellulaire massive entraîne la libération d’antigènes qui devraient normalement rester à l’intérieur
des cellules et sont récupérés par les CPA puis présentés via le CMH II.
C’est par exemple le cas lors de maladies métaboliques comme l’infarctus : l’arrêt brutal de
la circulation dans un tissu donné provoque la mort brutale d’une quantité très importante de
cellules et donc la libération massive d’antigènes du soi, récupérés par les CPA.
Les facteurs rhumatoïdes sont un cas particulier : il s’agit d’anticorps dont le fragment Fc est
anormal (absence de galactose) et qui entraînent donc la formation de complexes antigènes-
anticorps également anormaux.
c)réaction croisée.

Immuno – L’auto-immunité – page 46
Le problème survient lorsque l’épitope d’un agent pathogène est suffisamment proche d’un épitope
du soi pour que les effecteurs formés par la réponse immunitaire contre ce pathogène soient
capables de reconnaître l’antigène du soi.
Normalement, tout LB auto-réactif nécessite l’aide du LT spécifique de l’antigène pour être activé
or si tout est normal un LT CD4+ auto-réactif ne peut pas réagir (il est détruit dans le thymus ou
circule mais est contrôlé) et ne peut donc pas activer le LB auto-réactif.
Le problème, c’est si l’animal est infecté par un pathogène dont un des antigènes ressemble
beaucoup à une portion d’un antigène du soi (l’extrémité par exemple, le reste de l’antigène étant
différent ). L’antigène pathogène est phagocyté par la CPA, coupé en morceaux qui sont présentés
au LT CD4+. Si ce dernier reconnaît le morceau correspondant à la fameuse extrémité, il va
s’activer et donc pouvoir activer le LB auto-réactif qui lui reconnaît l’antigène du soi. Il va donc y
avoir production d’auto anticorps, qui vont provoquer une inflammation locale qui va entretenir la
réponse immunitaire.
Ce phénomène est assez fréquent chez les animaux, par exemple lors d’uvéites chez le cheval dues
à des infections à Leptospira. Chez l’homme, des angines à streptocoque peuvent entraîner des
myosites cardiaques.
d)facteurs génétiques
Pour le CMH de classe I ou II, différents allèles sont exprimés à la surface des cellules, chaque
allèle ayant des propriétés différentes et permettant donc de présenter des peptides différents.
Ainsi, plus l’individu possède d’allèles différents, plus il va être capable de présenter tous les
peptides correspondant à des antigènes. Il va donc pouvoir lutter contre un grand nombre
d’infections, MAIS ÉGALEMENT être susceptible de présenter des peptides du soi et donc de
développer des MAI.
Il existe donc un nombre idéal d’allèles
(qui correspond en général à celui que présente
la majorité des espèces animales) qui permet
une bonne réponse aux infections tout en
limitant le risque de MAI.
ex : chez l’homme, 6 allèle pour le CMH I, 8
pour le CMH II.
Le polymorphisme de certaines molécules du

Immuno – L’auto-immunité – page 56
SI peut également parfois poser problème, par ex le TNF ou le complément dont l’expression est
également allélique (certains allèles du C3 sont par exemple +/- efficaces ou même « pro-MAI »).
Tous les individus ne sont donc pas sensibles de la même façon aux MAI, il existe un fond
génétique déterminant.
e)rôle des hormones
Certaines hormones jouent également un rôle clé :
Les hormones sexuelles : lors de la puberté (=moment de leur apparition), il y a
modification de certains antigènes du soi et donc apparition de nouveaux antigènes du soi encore
jamais présentés.
Elles influencent également la nature de la réponse immunitaire en favorisant la Th-1 ou 2 (ex : lors
de la gestation) et favorisent ainsi certaines MAI (ce qui explique parfois les prévalences différentes
entre les mâles et les femelles).
Les hormones liées au stress, qui sont toutes immunosuppressives. Elles entraînent un
dysfonctionnement des LTReg et donc favorisent les crises ou aggravent les signes cliniques déjà
présents.
A RETENIR que l’étiologie est TOUJOURS MULTI-FACTORIELLE.
Si on n’intervient pas médicalement, on assiste à un phénomène d’auto-emballement, qui tend
toujours vers l’aggravation, car au fur et à mesure que les organes sont détruits, il y a apparition
d’autres antigènes du soi qui stimulent encore plus le SI.
CCL:
L'activ
ation
des
cellule
s auto-
réactiv
es se
fait
par la
reconn
aissan
ce de
l'Ag
du soi
via : - r
é
a
c
t
i
o
n
c
r
o
i
sée.
 6
6
1
/
6
100%