Immunologie Livre de référence: Janeway La réponse immunitaire

Immunologie
Livre de référence: Janeway
La réponse immunitaire met en jeu un ensemble de cellules, de molécules, qui sont devenues de
plus en plus complexes au fur et à mesure de l'évolution des espèces. Ces mécanismes cellulaires et
moléculaires ont évolué en fonction de l'adaptation de l'agent infectieux à l'hôte (il y a également
une adaptation de l'hôte à l'agent infectieux).
Les mécanismes les plus importants appartiennent à 2 formes d'immunité:
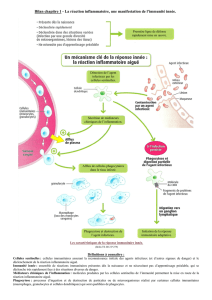
• Immunité innée: première ligne de défense vis-à-vis d'un agent infectieux (entre 0 et 72 heures).
Cette forme d'immunité existe chez tous les organismes pluricellulaires.
Caractéristiques:
- Mis en jeu immédiate.
- Fait intervenir un certain nombre de modules qui ont des fonctions distinctes. Ces modules
peuvent être constitutifs (barrière cutanéomuqueuse), induits (phagocytose) et surtout la
réponse inflammatoire.
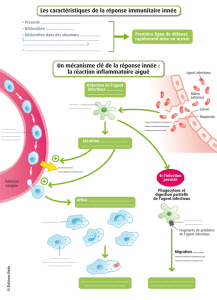
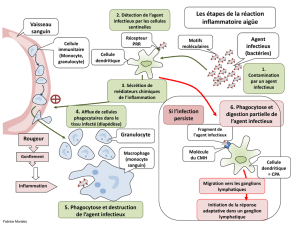
Le signal est déclenché par des interactions PAMPs/PRRs. Les PAMPs sont des constituants
d'agents infectieux (Pathogens Associated Molecular Patterns) qui peuvent être sur les agents
infectieux, ou libres, et sont reconnus par des PRRs (Patterns Recognition Receptors) par des
interactions spécifiques. Ces interactions déclenchent un signal danger.
Les cellules qui interviennent sont variées:
- Macrophages.
- Cellules dendritiques.
- Cellules NK (Natural Killer).
- PN neutrophiles, éosinophiles, basophiles.
- Mastocytes.
- Cellules résidentes: cellules constitutives d'un organe ou d'un tissu. Ces cellules sécrètent
des cytokines.
Ce sont des cellules qui ne se multiplient pas.
• Immunité adaptative spécifique: elle est plus tardive (elle met quelques jours pour se mettre en
place). On la trouve que chez les vertébrés. Elle évolue depuis des millions d'années et elle fait
intervenir les lymphocytes T et B. Les lymphocytes vont porter, à leur surface, des récepteurs (TCR
pour les T et BCR pour les B: T/B Cell Receptor) qui sont codés par des gènes qui ont subi des

réarrangements somatiques et qui reconnaissent un seul ligand. Il faut des quantités énormes de
lymphocytes qui aient des récepteurs adaptés à tous les antigènes du monde extérieur. Un
lymphocyte va reconnaître un antigène particulier et va proliférer. Les lymphocytes T, après avoir
rencontrés l'antigène, vont se transformer en cellules effectrices:
- LTCD4 → LT helper.
- LTCD8 → tueurs (lymphocytes T cytotoxiques).
Les lymphocytes B vont se transformer en plasmocytes, qui vont produire les anticorps.
Le contrôle de la réaction immunitaire se fait par des cellules appelées les lymphocytes T
régulateurs.
Le système immunitaire va se souvenir du premier contact et il va se mettre en place une mémoire
immunitaire qui est très importante: en cas d'un nouveau contact avec l'agent infectieux, la réponse
spécifique sera plus intense et plus spécifique.
Tous les mécanismes qui se développent vont également agir en augmentant la réponse innée (par
exemple, les anticorps vont augmenter la phagocytose). Les cellules NKT (Natural Killer T) et LT
γ/δ sont entre l'immunité innée et l'immunité adaptative spécifique.
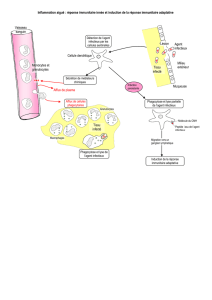
Les deux formes d'immunité sont extrêmement liées: les cellules dendritiques phagocytent l'agent
infectieux et vont quitter les tissus périphériques pour amener l'antigène dans les organes
lymphoïdes secondaires (ganglions lymphatiques, rate, amygdales, appendice). On parle également
de cellules présentatrices de l'antigène. Au départ, les lymphocytes T et B sont dans les organes
lymphoïdes et sortent par la lymphe pour rejoindre la circulation sanguine. Ceci permet l'immunité
adaptative spécifique.
I) L'immunité innée
A) Les interactions PAMPs/PPRs
1) Les PAMPs, « pathogens associated molecular patterns »
• Présents sur les microorganismes pathogènes et non pathogènes. Sur les microorganismes non
pathogènes, les PAMPs sont en quantité plus faible et moins exposés, donc il n'y a pas de réponse.
• Invariants sur les microorganismes d'une certaine classe.
• Produits par des voies propres aux microorganismes (non soi): notre organisme n'exprime pas ces
constituants.
• Rôle essentiel dans la physiopathologie de ces microorganismes.
Bactéries: composants de paroi: LPS (lipopolysaccharide), peptidoglycanne, acides
lipotéichoïques, lipoprotéines.
Champignons: β glucannes.
Virus: acides nucléiques, modifications propres aux virus, localisations particulières.
Ces molécules déclenchent la réponse immunitaire innée.
2) Les PRRs, « pattern recognition receptors »
Il existe plusieurs formes de PRRs:
• PRRs solubles:
- composants du complément (ensemble de molécules dans les fluides, qui interagissent les
unes avec les autres, ce qui permet la phagocytose et le déclenchement de la réaction
inflammatoire).
- collectines: MBP (mannan binding protein).
- pentraxines: CRP (Creactive protein) phagocytose: CRP est une protéine de
l'inflammation.

- LBP: LPS-binding protein, transfert à d'autres PRRs.
• PRRs membranaires:
- impliqués dans la phagocytose: récepteur du mannose, récepteurs scavengers, récepteurs
du complément, lectines de type C (dectin-1).
- activation de voies de signalisation: réponse inflammatoire et anti-virale (TLRs).
- transfert vers d'autres PRRs: CD14.
• PRRs cytoplasmiques:
- impliqués dans la reconnaissance de composants bactériens intra-cellulaires ou de
composants viraux: ADN, ARN, … réponse inflammatoire et anti-virale.
Ex: NLRs (protéines NOD), RLRs.
Il y a donc des PRRs partout, ce qui permet de détecter l'agent infectieux quelque soit le
compartiment où il se trouve.
Dans la majorité des cas, les PRRs vont conduire à la phagocytose.
Le complément joue un rôle dans la phagocytose et dans la réaction inflammatoire.
a) Le complément
C'est un ensemble de protéines plasmatiques (au moins une vingtaine) qui vont réagir les unes avec
les autres. C'est un système en cascade. Le complément va assurer le déclenchement de la réponse
inflammatoire et favoriser la phagocytose.
On les trouve dans tous les fluides corporels. Un certain nombre des protéines du complément sont
des protéases, qui sont activées par un clivage protéolytique.
La découverte du complément a été réalisée par Jules Bordet. Il s'était rendu compte que, lorsqu'il
mettait des bactéries avec du sérum frais contenant des anticorps dirigés contre cette bactérie, il
obtenait une lyse de ces bactéries à 37°C. Lorsqu'il chauffe ce sérum à 56°C (les anticorps ne sont
pas détruits), il constate qu'il ne lyse plus les bactéries. Il montre ainsi que cette lyse bactérienne est
due aux anticorps et à un facteur thermolabile dépourvu de spécificité qu'il dénomme alexine, puis
nommé complément (car ces protéines agissent en complément des anticorps).
Jules Bordet a également découvert l'agent de la coqueluche.
Il existe 3 voies d'activation du complément:
• La voie classique déclenchée par la fixation du C1q, soit directement sur les agents infectieux, soit
sur la CRP, soit sur le complexe Ag-Ac.
• Voie MBP (Mannane-binding protein) déclenchée par la fixation de la MBP au mannose qui est
sur les bactéries.
• Voie alterne.

Ces 3 voies vont aboutir à la formation de la C3 convertase qui permet la production d'un certain
nombre de protéines qui entraînent l'inflammation (C4a, C5a, C3a), l'opsonisation (C3b) et la
destruction directe des agents pathogènes (C5b, C6, C7, C8, C9).
Il existe des systèmes régulateurs.
Activation de la voie classique:
Le C1q est une lectine (protéine qui reconnaît des sucres) qui a une forme de bouquet de tulipes (6
sous-unités, chacune formée de 3 chaînes). Le C1q est associé à 2 molécules de C1r et 2 molécules
de C1s.
C1 = C1q, C1rx2, C1sx2
Les têtes globulaires vont reconnaître des sucres à la surface des agents infectieux, et vont se fixer.
Cette fixation va entraîner un changement conformationnel du C1r, ce qui va l'activer et le C1r va
cliver le C1s, qui devient une sérine-protéase active. Le C1s va recruter et cliver une autre protéine
du complément appelée le C4, en 2 fragments:
- un petit fragment, C4a qui reste dans le milieu plasmatique.
- C4b qui va se fixer de manière covalente au niveau de la surface bactérienne. S'il ne se fixe
pas, il va rapidement être dégradé.
Le C4b va recruter et fixer le C2 pour l'exposer à l'action protéasique du C1s, ce qui conduit à la
formation du C2a qui reste libre et à un complexe 'C4b, 2b' appelé la C3 convertase (ou C3
convertase classique).
La C3 convertase va recruter une autre protéine, la C3, qui va être clivée en une petite molécule C3a
qui reste soluble et il se forme 2 choses: du C3b qui est formé en très grande quantité. Une partie du
C3b va s'accrocher au premier complexe pour former le 'C4b, 2b, 3b' qui est également appelé la C5
convertase. L'autre partie du C3b va se fixer, tout seul, à la surface de l'agent infectieux. Le C3b est
une opsonine qui va permettre la phagocytose de l'agent infectieux par les macrophages (présence
de récepteurs spécifiques).
Le MBP a la même structure que le C1q (présence de MASP-1 et MASP-2), ce qui explique
pourquoi la voie du MBP est exactement la même que celle du C1.
Voie alterne:
Elle commence par le C3.
On admet qu'il y a, en permanence dans les liquides, une hydrolyse du C3, ce qui conduit à la
formation du C3a et du C3b. Le C3b va se fixer sur les surfaces bactériennes. Le C3b va s'associer à
un facteur appelé B pour former un complexe qui va être clivé par une enzyme appelée D. Le
complexe 'C3b, Bb' est appelé la C3 convertase alterne qui va agir sur le C3 qui va être clivé en C3a
et C3b. Le C3b a denouveau 2 possibilités:
- fixation au complexe de départ pour former le complexe 'C3b, Bb, 3b' ou C5 convertase
alterne.
- fixation du C3b qui va servir d'opsonine (élément intermédiaire qui favorise la
phagocytose).
La C3 convertase alterne est stabilisée par la properdine.
A la fin des différentes voies, on a les C5 convertases (alterne et classique) et du C3b.
Conséquences:
• Opsonisation, qui nécessite des récepteurs.

Récepteurs du complément:
Récepteurs
Ligands
Fonctions
Cellules
CR1
C3b
- Phagocytose
- Transport des complexes immuns par les GR
monocytes/macrophages
polynucléaires
CD
LB, GR
CR2
C3dg
C3bi
EBV
- corécepteur LB
- récepteur EBV
LB
CD
CR3
(CD11b,
CD18)
C3bi
Phagocytose
monocytes/macrophages
polynucléaires
CD
CR4
(CD11c,
CD18)
C3bi
Phagocytose
monocytes/macrophages
polynucléaires
CD
• Déclenchement de la réaction inflammatoire qui est liée à la présence de petits fragments appelés
anaphylatoxines (provoquent un choc anaphylactique lorsqu'on les injecte). Les anaphylatoxines
augmentent la contraction des muscles lisses, augmentent la perméabilité vasculaire, activent les
mastocytes, et font apparaître des molécules d'adhésion sur les cellules endothéliales. Ceci permet
de faire passer dans les tissus des cellules qui, normalement, ne s'y trouvent pas (ex: polynucléaires,
monocytes, …). Ce recrutement de cellules permet la phagocytose.
Le complément permet la phagocytose des bactéries grâce à la présence de C3b sur leur surface, et
augmentent, au point d'infection, le nombre de cellules capables de phagocyter.
• Lyse bactérienne: les C5 convertases vont cliver le C5 pour former un petit fragment qui est le
C5a (anaphylatoxine) et le C5b. Le C5b va s'associer avec le C6 et le C7. Le C7 subit un
changement de conformation qui permet l'insertion du complexe 'C5b, 6, 7' dans la membrane. Le
complexe va ensuite fixer le C8 qui va également s'insérer dans la membrane. Il y a ensuite addition
du C9, et il y aura une polymérisation de plusieurs C9, ce qui va permettre la formation de pores (10
nm de diamètre, 15 nm de hauteur).
Contrôle de l'activation du complément:
• Inhibiteur du C1: C1INH: se fixe au C1r et C1s et les dissocie du C1q (limite le temps pendant
lequel ces enzymes peuvent cliver le C2 et le C4).
Déficit en C1INH: œdème angioneurotique héréditaire: production exagérée de C2a (kinine)
(œdème de la trachée).
• Inhibiteurs qui fixent le C4b et déplacent le C2b: CR1, C4BP (C4 binding protein), DAF
(decay accelerating factor: protéine membranaire).
• Inhibiteurs qui fixent le C3b et déplacent Bb: CR1, facteur H, DAF
• Facteur I:
- clive le C3b en C3bi puis en C3dg
- clive le C4b en C4bc puis en C4d: ce qui les inactive
A besoin de cofacteurs: CR1, C4BP, Facteur H, MCP (membrane cofactor protein (C4b)).
Déficit en facteur I: déplétion en C, grande sensibilité aux infections.
• CD59 (protéine fixée par un pont GPI): inhibe la fixation du C9.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%