Activités pratiques

ACTIVITES PRATIQUES DU CHAPITRE C3 4 ème _ 2004-05
Activité n°1 : Que se passe-t-il pendant la combustion du carbone ?
1. Complète :
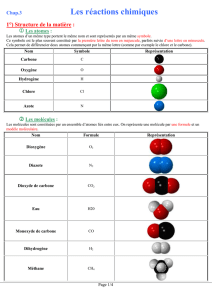
Le carbone est-il constitué
d’atomes ou de molécules ?
symbole
Modèle
Carbone
2. Écris le bilan en toutes lettres de la combustion du carbone dans le dioxygène (1ère ligne du
tableau n°1).
3. Construis les réactifs avec les modèles moléculaires dont tu disposes.
Appelle le professeur et vérifiez ensemble les constructions.
4. Construis le produit à partir des atomes utilisés pour construire les réactifs.
5. Que dois-tu faire pour cela :..................………………………………………………………….…..……
Appelle le professeur et vérifiez ensemble les réponses.
6. Reprends le bilan de la réaction en remplaçant les noms par les modèles. (2ème ligne)
Appelle le professeur et vérifiez ensemble les réponses.
7. L’équation chimique est l’écriture symbolique de la réaction chimique. Remplace les modèles
par les symboles et les formules. Complète le tableau (3ème ligne).
Appelle le professeur et vérifiez ensemble les réponses.
8. Fais l’inventaire des atomes de carbone présents dans les réactifs et dans les produits (4ème
ligne). Fais le même compte pour les atomes d’oxygène.
9. Qu’est-ce qui se conserve au cours d’une réaction chimique ? ………………………………………..
10. Sachant que la masse d’un atome reste toujours la même, qu’est-ce qui se conserve aussi ?
…………………………………………………………….............................................….……..…………
Activité n°2 : Que se passe-t-il pendant la combustion du méthane ?
1. D’après le modèle des particules de méthane, remplis le tableau suivant :
Le méthane est-il constitué
d’atomes ou de molécules ?
formule
Modèle
Méthane
Appelle le professeur et vérifiez ensemble les réponses.
2. Écris le bilan en toutes lettres de la combustion du méthane (1ère ligne du tableau n°2).
3. Construis les réactifs avec les modèles moléculaires dont tu disposes.
4. Construis les produits en utilisant seulement les atomes des réactifs.
Quel est le problème qui se pose ? .......................................................................……………...........….
Appelle le professeur et vérifiez ensemble les réponses.
5. Si tu ne peux pas construire les produits à partir des réactifs, c’est qu’il faut rajouter des
molécules soit de méthane, soit de dioxygène. Faut-il rajouter des molécules de méthane ou des
molécules de dioxygène ?…………………………………..Combien ? ……..…………..………………
Appelle le professeur et vérifiez ensemble les réponses.
6. Complète la 2ème ligne du tableau en dessinant les molécules manquantes, de manière à
respecter la conservation des atomes lors de la réaction chimique.
7. Écris l’équation chimique de la réaction en indiquant, devant chaque formule chimique, le nombre
de molécules nécessaires (3ème ligne).
8. L’équation chimique doit traduire la conservation des atomes. Vérifie que c’est bien le cas (4ème
ligne) sinon corrige.

Tableau n°1 :
les réactifs réagissent pour former les produits
Bilan
………………. + ………………….. …………………………………
Modèle
+
Équation chimique
………………. + ………………….. …………………………………
nombre d’atomes
de carbone :
dans les réactifs : ....................
dans les produits : ....................
d’oxygène :
dans les réactifs : ....................
dans les produits : ....................
Tableau n°2 :
Bilan
……………. + ……………….. ……… + ………………………
Modèles
+
+
Équation chimique
… ………. + … ………….. … ………… + … …………
nombre d’atomes
de carbone :
dans les réactifs : ....................
dans les produits : ....................
d’hydrogène :
dans les réactifs : ....................
dans les produits : ....................
d’oxygène :
dans les réactifs : ....................
dans les produits : ....................
Tableau n°1 :
les réactifs réagissent pour former les produits
Bilan
………………. + ………………….. …………………………………
Modèle
+
Équation chimique
………………. + ………………….. …………………………………
nombre d’atomes
de carbone :
dans les réactifs : ....................
dans les produits : ....................
d’oxygène :
dans les réactifs : ....................
dans les produits : ....................
Tableau n°2 :
Bilan
……………. + ……………….. ……… + ………………………
Modèles
+
+
Équation chimique
… ………. + … ………….. … ………… + … …………
nombre d’atomes
de carbone :
dans les réactifs : ....................
dans les produits : ....................
d’hydrogène :
dans les réactifs : ....................
dans les produits : ....................
d’oxygène :
dans les réactifs : ....................
dans les produits : ....................
1
/
2
100%