On se propose d`étudier le fonctionnement d`un flash d`appareil photo

Nom Prénom : …..……………………
Durée : 2 heures
EXERCICE 1 (1,5 pts) : A la suite d’un choc entre une particule et un noyau d’azote 14, il se forme un proton et un
noyau d’un isotope de l’oxygène.
1°) Ecrire l’équation de cette réaction nucléaire en justifiant. De quel type de réaction s’agit-il ?
2°) Calculer l’énergie libérée en Joule .
Données : particule (
2
4He) : 4,0026 u ; 7 14N : 14,0031 u ; proton ( 1 1P) : 1,0078 u ;
noyau de l’isotope de l’oxygène : 16,9991 u rappel : 1u=1,66054
10-27 kg c=3,00
108 m/s
EXERCICE 2 (5,5 points) :
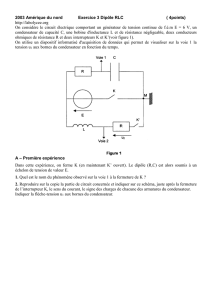
On réalise le montage représenté sur la figure ci dessous.
On indique la tension aux bornes du générateur : E = 8 V et la valeur de la résistance R = 2,2 k
L’inductance de la bobine est L = 0,80 H et sa résistance r = 10 . R’ = 100
Première partie :
A un instant pris comme origine des dates on ferme l’interrupteur K1 , K2 restant ouvert.
On observe la charge du condensateur en suivant l’évolution de la tension uC = f(t)
1.1 Etablir que l’équation différentielle dont la tension uC est solution est : E = uC + RC
Error!
(On s’appuiera sur le schéma du circuit fourni en annexe et sur lequel on fera apparaître les tensions E, uC et uR)
1.2 Montrer que uc(t) = E ( 1 – e-t/
) est solution de l’équation différentielle et que le paramètre
est imposé par les
caractéristiques du circuit (Exprimer
2.1. La courbe donnant les variations de uC au cours du temps est donnée en document 1.
En exploitant cette courbe, déterminer la constante de temps
du circuit. (Indiquer la méthode employée)
2.2 La capacité du condensateur utilisé est-elle de 220 nF ; 470 nF ; 1,0 µF ou 2,2 µF ? (Répondre en justifiant
votre choix )
3. Au bout de quelle durée peut-on considérer que la tension aux bornes du condensateur n’évolue plus ?
Deuxième partie :
Une fois la tension aux bornes du condensateur établie à 8V, on ouvre l’interrupteur K1 et on ferme l’interrupteur K2. La
date de fermeture de K2 est prise comme nouvelle origine des temps.
L’acquisition de la tension aux bornes de uc au cours du temps donne la courbe produite en document 2.
1.1 Quel est le phénomène observé ?
1.2 Quelle est l’origine de l’amortissement observé ?
2.1 Déterminer avec le maximum de précision la pseudo-période T de la tension uc. Expliquer.
2.2 En admettant que la pseudo-période et la période propre sont quasi identiques, retrouver par le calcul la
valeur de la capacité C du condensateur.
2.3 Donner la valeur de l’énergie emmagasinée par le condensateur à t=0 s. Indiquer le temps qu’il faudra pour
que toute l’énergie soit stockée dans la bobine (Justifier)
- Devoir surveillé de sciences physiques n°8
Physique (13 pts)
K1
C
E
R
K2
L
r
R’
C

ANNEXE DE L’EXERCICE 2 : A RENDRE AVEC LA COPIE
Schéma du circuit à compléter :
DOCUMENT 1:
DOCUMENT 2 :
EXERCICE 3 : 6 points
t (ms)
t (ms)
uc
uC
Nom :
Prénom :
E
K
1
R
C
+
—
R

Une auto ayant une masse de 900 kg se déplace sur une route horizontale. On évalue les forces de frottement
avec la route indépendantes de la vitesse à 300 N / tonne.
1. En partant du repos, la voiture atteint une vitesse de 90,0 km/h en 50,0 secondes. Trouver l’accélération
moyenne de cette voiture. En déduire la force de traction du moteur, supposée constante.
2. Quelle force le moteur doit-il développer pour maintenir constante cette vitesse de 90,0 km/h ?
A un certain moment, le conducteur décide d’arrêter le moteur sans serrer les freins. Déterminer la nouvelle
accélération moyenne. Au bout de combien de temps la voiture s'arrêtera-t-elle et quel sera le chemin
parcouru ? (en prenant comme position d’origine l’endroit où le moteur a été arrêté).
3. Lorsqu'on agit sur les freins (avec le moteur à l’arrêt), la voiture s'arrête après avoir parcouru 125 m (par
rapport à l’endroit où l’on a agit sur les freins), la vitesse initiale étant toujours de 90,0 km/h. Trouver la
valeur de l’accélération moyenne et le temps mis pour s’arrêter (l’origine des temps est pris quand on agit
sur les freins).
EXERCICE 4 : 7 points
1.a°) Les numéros atomiques du sodium et du magnésium sont respectivement 11 et 12.
Justifier que leurs ions monoatomiques soient respectivement Na+ et Mg2+.
b°) L'équation de la réaction : Mg(s) + 2H+ = Mg2+ +H2(gaz) a pour constante d'équilibre associée K= 1075.
Donner l'expression de cette constante.
Un système chimique est composé à l'état initial de magnésium métallique, d'ions H+ tels que pH=2,0,
d'ion Mg2+ de concentration 1,00.10-5 mol/L et d'ion Cl-. Calculer la valeur initiale du quotient de
réaction. Dans quel sens évolueront les concentrations des ions en solution ?
c°) Quelle est la conductivité initiale de la solution ? Comment va-t-elle évoluer ?
Données : H+) = 35
10-3 S.m² .mol-1.; Cl-) = 7,6
10-3 S.m² .mol-1; Mg2+ ) = 10,6
10-3 S.m² .mol-1.
On considéra la concentration des ions HO- négligeables.
2. On réalise le montage suivant :
La solution de chlorure de magnésium est neutre initialement du point de vue acido-basique. On constate la
formation de bulles sur l'électrode de platine et pas sur l’électrode de magnésium. Cette dernière voit sa masse
diminuée. X est une résistance électrique.
- Ecrire la ½ équation ayant lieu pour chaque électrode en indiquant le pôle+ et – sur la pile réalisée.
- Décrire le déplacement des porteurs de charge (en justifiant) au sein de ce dispositif (schéma ci-dessus).
- On remplace X par un voltmètre. Comment faut-il le brancher pour que la mesure affichée soit positive.
- Comment évolue le pH de chaque solution au cours de l'expérience ?
- Quel volume de H2 s'est-il formé au bout de 10 heures avec une intensité de courant constante de valeur
I=50 mA.
- Quelle masse de magnésium a été consommée au niveau de l’électrode de Mg ?
Données : Volume molaire = 24 L/mol. Constante de Faraday= 96500 C/mol MMg=24,3 g/mol
1
/
3
100%