du genotype au phenotype

URL source du document
www.lucieberger.org/svt
Document
DU GENOTYPE AU PHENOTYPE
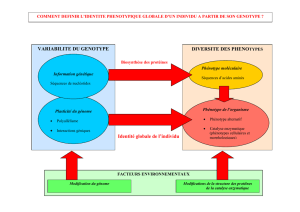
Le phénotype est l'ensemble des caractères observables (morphologiques, physiologiques,
biochimiques) d'un individu.
Nous envisagerons les relations entre l'information génétique et les conséquences phénotypiques
de son expression.
Eléments requis:
notions de phénotype et de caractère,
signification d'un acide aminé dans une protéine,
comprendre une expérience de digestion in vitro en analysant les produits obtenus par un
réactif (lugol, liqueur de Fehling),
connaître la structure de la molécule d'ADN et sa signification dans la cellule.
Thèmes traités et activités pédagogiques (durée: 6 semaines):
Phénotype et protéines
Synthèse des protéines
Gènes, phénotypes et environnement
Thème 1: Phénotype et protéines
1.1 LA REALISATION DU PHENOTYPE
1.1.1 Les échelles d'observation du phénotype: la sicklémie
- l'organisme: dans la sicklémie ou drépanocytose, maladie héréditaire du
sang, rien ne distingue extérieurement un individu sain d'un malade: ce dernier
présente une anémie chronique, des crises de douleurs articulaires (la
radiographie révèle des nécroses osseuses et cartilagineuses); la mortalité est
élevée.
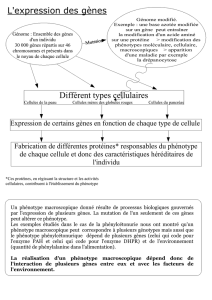
- la cellule: au niveau cellulaire, les hématies ont une forme de faucille chez
les malades lorsque la pression en dioxygène est faible, une forme de disque
biconcave chez les sujets sains.
Observé au microscope électronique, le globule rouge drépanocytaire
désoxygéné apparaît rempli d'un gel formé par des cristaux allongés longs de 1
à 15 µm constitués par des polymères d'hémoglobine: déformé par ces
structures fibreuses tubulaires, il prend une forme caractéristique en faucille.
- la molécule: l'hémoglobine est une protéine du cytoplasme des hématies. Elle
est constituée de quatre chaînes polypeptidiques identiques deux à deux: deux
chaînes et deux chaînes .

Vous allez utiliser le logiciel ANAGENE:
(version de démonstration:
http://www.cndp.fr/svt/anagene/telechargement.htm)
1 - Ouvrez le logiciel ANAGENE et choisissez dans "Thèmes d'étude":
"RELATIONS GENOTYPE-PHENOTYPE".
2- Choisissez "Phénotype drépanocytaire". Les séquences nucléiques et
protéiques s'affichent. Sélectionnez, à gauche, HbS protéique et HbA
protéique: cette dernière sera prise comme référence ( ).
3 - Comparez les séquences de la protéine normale HbA et de la protéine des
malades HbS (il s'agit des chaînes ), en optant pour "alignement avec
discontinuité" dans la fenêtre de dialogue.
4 - Faites apparaître les identités * et la (ou les) différence(s).
5 - Dites par quoi la molécule d'hémoglobine des malades (HbS) se distingue
de l'hémoglobine normale (HbA).
Ces trois niveaux du phénotype (organisme, cellule, molécule) découlent les
uns des autres:
polymérisation moléculaire => fibres déformant les globules =>
fragilisation et destruction de ceux-ci, provoquant l'anémie.
1.1.2 Les protéines-enzymes:
la réalisation du phénotype dépend étroitement de l'intervention des protéines.
Une protéine est une molécule réalisant une fonction biologique donnée.
Exemples:
- hémoglobine et transport des gaz respiratoires,
- myosine et actine interviennent dans la contraction musculaire.
Parmi ces protéines, certaines, les enzymes jouent un rôle important: nous
prendrons l'exemple de la synthèse de la mélanine, pigment donnant sa couleur
à la peau.
Pour illustrer ce fait, à défaut de faire l'observation directement au microscope,
vous pourrez consulter le portail du Département d'Histologie et d'embryologie
de la faculté Universitaire FUNDP de NAMUR. Choisissez la rubrique "Histologie
spéciale humaine - Système cutané - Epiderme".
Observation microscopique de coupe de peau
humaine
Après avoir observé ...
- au faible grossissement, les mélanocytes des couches
profondes de l'épiderme,
- à un plus fort grossissement, au microscope électronique les
mélanosomes cytoplasmiques,
vous rendrez compte de vos observations par deux dessins.
Vous utiliserez les explications fournies pour faire apparaître,

dans vos annotations, le devenir des grains de mélanine dans la
peau.
La voie de biosynthèse de la mélanine est connue: elle débute par l'intervention
d'un précurseur, un acide aminé, la L-tyrosine, et comprend six étapes:
Les deux premières étapes (1) et (2) sont catalysées par une même enzyme: la
tyrosinase. C'est le défaut d'activité de cette enzyme qui est responsable de
l'absence de mélanine, donc de l'albinisme (phénotype se caractérisant
notamment par l'absence de coloration au niveau de la peau). Ainsi les
molécules protéiques que sont les enzymes, par leur présence ou leur absence,
interviennent dans la réalisation du phénotype.
Une protéine est constituée d'un enchaînement d'acides aminés: il en existe 20
naturels. Le nombre d'acides aminés constitutifs variant d'une protéine à
l'autre, les protéines se caractérisent donc par leur extrême diversité (un
enchaînement de n acides aminés offre 20en séquences différentes).
La diversité des protéines est donc à l'origine de la variabilité des caractères
phénotypiques. Il en est de même pour les phénotypes alternatifs d'un même
caractère.
1.2 LES ENZYMES, DES PROTEINES ESSENTIELLES
Etude expérimentale de l'hydrolyse
enzymatique du saccharose
Après avoir observé des cellules de levure de
boulanger (Saccharomyces cerevisiæ) au
microscope à partir d'une culture bien oxygénée
(10g de levures dans 100 mL d'eau, soit 10%) et
réalisé une solution de saccharose à 3%, vous
répartirez dans 5 tubes à essais placés au bain-
marie à 30°C:
- tube 1: 2mL de solution saccharosée
- tube 2: 2 mL de culture de levure
- tube 3: 2mL de solution saccharosée + 2 mL de culture de levure
- tube 4: 2mL de solution saccharosée + 2 mL de filtrat de culture de levure
- tube 5: 2mL de solution saccharosée + 2 mL de culture de levure (portés au
préalable à ébullition puis refroidis)

Suivez la réaction d'hydrolyse à l'aide d'un glucomètre. Interprétez. Comparez cette
hydrolyse enzymatique avec l'hydrolyse chimique.
Voyez l'animation concernant l'hydrolyse du saccharose.
1.2.1 La catalyse enzymatique:
<>- les enzymes sont des biocatalyseurs,
- les enzymes agissent à faible concentration,
- la vitesse d'une réaction enzymatique est élevée (~1000 molécules de
substrat / seconde),
- les enzymes agissent dans les conditions biologiques (température et
pression compatibles avec la vie).
1.2.2 Spécificités enzymatiques de substrat et d'action
- une enzyme donnée n'agit que sur un seul substrat (son nom indique la nature
du substrat sur lequel elle agit): ainsi une saccharase hydrolyse le saccharose,
une amylase, l'amidon, ...
N.B. sur un substrat, plusieurs enzymes peuvent agir, mais la reconnaissance se
fait sur une partie différente de la molécule.
- sur un substrat, une enzyme catalyse un seul type de réaction: ainsi la
tyrosine-hydrolase transforme la tyrosine en L-dopa, la tyrosine-kinase en
tyrosine-phosphate, ...
1.2.3 Le complexe enzyme-substrat: un exemple, la carboxy-peptidase, une
enzyme synthétisée par le pancréas et déversée dans l'intestin grêle,
Sur le site ci-dessous vous sélectionnerez l'étude intitulée: "Structure-fonction
d'un complexe enzyme-substrat, la carboxypeptidase" :
http://www.inrp.fr/Acces/Biogeo/model3d/chimespt.htm

Vous réaliserez l'étude proposée qui concerne:
la structure de la carboxypeptidase, enzyme digestive qui hydrolyse
l'extrémité carboxyl-terminal dans une chaîne polypeptidique:
la localisation du site catalytique de l'enzyme,
la formation du complexe enzyme-substrat,
la catalyse enzymatique proprement dite.
La catalyse enzymatique nécessite la fixation temporaire de l'enzyme sur le
substrat (complexe E-S) par l'intermédiaire du site actif de l'enzyme:
Enzyme + Substrat -> E-S -> E + Produits
L'activité enzymatique s'évalue en mesurant la vitesse de la réaction catalysée
(quantité de substrat transformé ou quantité de produits formés).
Le suivi d'une réaction enzymatique par colorimétrie:
Il est possible de suivre la façon dont une réaction enzymatique se déroule en
utilisant la technique d'ExAO. Le capteur utilisé dépend de la réaction étudiée.
Dans l'exemple ci-dessous nous utilisons un luxmètre et le dispositif
confectionné permet de faire une mesure colorimétrique de la réaction
enzymatique d'hydrolyse de l'amidon.
Principe de la mesure colorimétrique: on colore initialement la solution
colloïdale d'empois d'amidon (substrat S) par le Lugol (réactif) en bleu. En
introduisant au temps t = O la solution enzymatique (E), la réaction se traduit
par la diminution de la concentration en substrat, donc par la décoloration de la
solution: d'abord en rouge vineux témoignant de l'appariton de dextrines, puis
en orangé-jaune (couleur du Lugol) correspondant à la disparition totale de
l'amidon et à l'apparition de maltose et d'un peu de glucose (produits P).
C'est la variation de la quantité de lumière absorbée par le milieu (absorbance)
qui est la variable permettant de suivre la réaction: elle est mesurée par le
luxmètre qui détermine le % de lumière traversant l'enceinte transparente, par
rapport à la quantité de lumière maximale fournie par la lampe.
L'usage d'une lampe à lumière froide évite d'introduire un autre paramètre
variable par échauffement du milieu réactionnel.
Les mesures se font sur un temps court et la vitesse de la réaction est
déterminée en début de réaction (vitesse initiale Vo) de manière à prendre en
compte la vitesse maximale de la réaction (Vmax).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%