TP PHYSIQUE

TP PHYSIQUE SPECTRES LUMINEUX
SPECTRES D’EMISSION ET D’ABSORPTION
Un spectre est la figure obtenue par décomposition d'une lumière en une ou plusieurs radiations
monochromatiques.
Les spectres seront visualisés grâce à un spectroscope à réseau ou à prisme. Un réseau a le même effet
dispersif sur la lumière que le prisme.
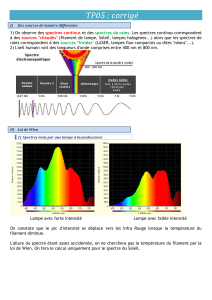
I/ Les spectres d’émission
On appelle spectre d'émission le spectre de la lumière émise directement par une source de lumière (ex:
soleil, lampes, étoiles ...)
1) Etude du spectre d'une lampe à incandescence
Expérience 1
- Brancher le générateur et le régler sur 6 volts. Pendant toute l'expérience, ne pas dépasser 6V.
- Vérifier que l’interrupteur est sur arrêt.
- Réaliser le circuit électrique en série : générateur - interrupteur - lampe 6V. Mettre l’interrupteur
sur marche.
- Diminuer la tension d'alimentation et observer.
a) Que faut-il faire pour rendre un corps incandescent ?
b) Comment évolue la température du filament de la lampe avec la tension électrique appliquée ?
Expérience 2
- Régler de nouveau le générateur sur le minimum. Augmenter la tension d'alimentation en observant
cette fois-ci le filament de la lampe avec un spectroscope.
a) Qu'observez-vous lorsque la température du filament est élevée ? Même question si la température du
filament est faible. (Faire un schéma du spectre pour chaque observation).
b) Comment le spectre de la lumière évolue-t-il lorsque la température du filament augmente ?
c) Quel renseignement un spectre d’émission peut-il fournir sur la source de lumière ?
2) Spectre d'émission d'un gaz excité
Principe :
Une lampe à décharge est un tube de verre contenant une vapeur métallique (mercure, sodium...) ou
un gaz (néon, argon...) sous faible pression. Lorsque le gaz est traversé par une décharge électrique,
il émet de la lumière.
Expérience :
- Observer les lumières émises par les différentes lampes (mercure et sodium) posées sur le bureau.
- Observer avec un spectroscope les spectres des lumières émises par ces lampes.
Exploitation
a) compléter le tableau ci-dessous.
Nom de la lampe
Couleur de la lumière
émise
Spectre d'émission de cette lampe

b) Observe-t-on des spectres d'émission continus ?
c) Pourquoi de tels spectres nous renseignent-ils sur la nature du gaz contenu dans l'ampoule de la lampe ?
II/ Les spectres d’absorption
On appelle spectre d'absorption, le spectre obtenu après que de la lumière blanche ait traversé une substance
(liquide ou gazeuse).
1) Expérience
Vous disposez de deux boîtes de Pétri contenant une solution de permanganate de potassium et une solution
de sulfate de cuivre. Entre la lumière blanche du rétroprojecteur et le réseau, on intercale successivement les
deux boîtes de Pétri. Observer les différents spectres d’absorption.
2) Exploitation
a) Qu'observez-vous pour chaque spectre d'absorption ? Qu’est-ce que cela représente ?
b) Compléter le tableau ci-dessous
Nom de la solution
Couleur de la
solution
Spectre d'absorption
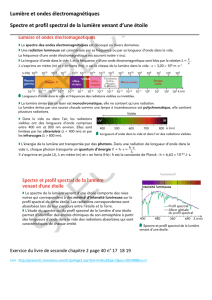
III/ Comparaison : spectre d’absorption, spectre d’émission
1) Deux expériences sont représentées ci-dessous. Dessiner les spectres observés sur l’écran, dire si ces
spectres sont des spectres d’émission ou d’absorption ; aidez-vous pour cela du document
2) Que pouvez-vous en conclure au sujet des radiations émises et absorbées par une substance ?
Lampe à vapeur de
sodium
lumière
blanche
prisme
Ecran
cuve avec des vapeurs de
sodium
Spectres observés sur l’écran
spectre ...................
spectre ....................
1
/
2
100%