La chimie au lycée

La chimie au lycée
Là où la nature cesse de produire ses propres espèces,
l'homme en se servant des choses naturelles,
en accord avec cette nature même,
commence à créer une infinité d'espèces.
1
Léonard de Vinci
Les grandes orientations de la réforme des programmes de chimie au lycée
“ Dans un cadre fondamental mais aussi culturel et appliqué, l'objectif essentiel pour la chimie est que
le bachelier scientifique ait assimilé les grands principes gouvernant la structure et l'évolution des
systèmes chimiques et ce, par une double approche macroscopique et microscopique ” (lettre de
cadrage du Conseil national des programmes).
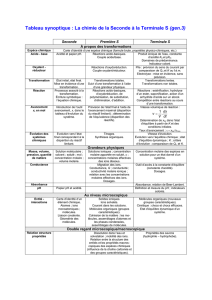
Le nouveau programme de chimie de la classe terminale de la série scientifique, en vigueur à partir de
la rentrée 2002, clôt la réforme des programmes de lycée et, comme on va le voir, trouve ses racines
dès la classe de seconde.
Les concepts introduits en classe de seconde
Chimique ou naturel ?
La matière qui nous entoure est le plus souvent constituée de mélanges de plusieurs espèces. La
question posée, “ chimique ou naturel ? ”, prend pour support des “ produits ” naturels essentiellement
constitués d’espèces chimiques organiques (glucose et amidon des fruits, acétate de linalyle de la
lavande, acide citrique et limonène des agrumes, etc.). Un “ produit naturel ” est un mélange très
complexe. Il est possible, dans certains cas simples, d'analyser ce mélange et parfois de reconstituer,
par synthèse, quelques unes des espèces qui le constituent.
L’élève se familiarise avec les techniques rencontrées au laboratoire de chimie organique et dans
l’industrie : extraction (par solvant et hydrodistillation), chauffage à reflux, lavage, séchage,
identification des espèces (CCM, grandeurs physiques, tests…) et synthèse. Il lui est montré qu’il n’y
a pas de différence entre une espèce synthétisée dans la nature et une espèce synthétisée au
laboratoire. On le sensibilise par ailleurs à la nécessité de la chimie de synthèse pour satisfaire les
besoins de la vie quotidienne.
La notion d’espèce chimique : comment l’introduire ?
Une espèce chimique est caractérisée par sa formule brute et par des propriétés physiques et
chimiques macroscopiques (température d’ébullition, de fusion, densité, indice de réfraction,
solubilités dans l’eau et dans des solvants organiques). Elle est constituée, au niveau microscopique,
par des entités individuelles (molécules, ions) dont on étudie les règles de constitution à partir des
atomes et la géométrie qui en résulte (règles de l'octet, du duet et représentations de Lewis).
Au-delà, la notion d’isomérie peut être illustrée à partir d’entités organiques comportant peu d’atomes.
L’élève apprend aussi à dénombrer les entités au niveau macroscopique en mesurant des quantités
de matière. A cet effet sont introduites les relations entre quelques grandeurs physiques simples
(masse, volume, pression) et les quantités de matière. Une initiation à la mesure en chimie est
proposée.
Transformation et réaction : quelle distinction ?
Ce qui est observé au plan macroscopique, c’est une transformation, faisant passer un système d’un
état initial à un état final. La combustion complète du méthane en est une, qui transforme un mélange
de méthane et d’air en excès en un mélange de diazote, de dioxyde de carbone, de dioxygène et
d’eau. La réaction chimique ne concerne que les espèces qui ont été effectivement consommées
(réactifs) ou qui sont apparues (produits) et l’équation chimique de cette réaction est un bilan fondé
sur les lois de conservation des atomes et des charges électriques.
1
Leonardo da Vinci (1452-1519). In effetti l’uomo non si varia dalli animali se non nella accidentale, col quale
esso si dimostra essere cosa divina, perche dove la nature finisce il produrre le sue spezie l’uomo quivi comincia
colle cose naturali a fare, coll’aiutorio d’essa natura infinite spezie… Disegni Anatomica (Dessins anatomiques,
Bibliothèque royale de Windsor).

État initial
État final
T = 298 K ; p = 1 bar
24 mol de diazote
6 mol de dioxygène
2 mol de méthane
Transformation chimique
T = 298 K ; p = 1 bar
24 mol de diazote
2 mol de dioxygène
2 mol de dioxyde de carbone
4 mol d’eau
La réaction chimique modélise la transformation par son bilan de matière : des réactifs (dioxygène et
méthane) ont réagi pour donner naissance à des produits (dioxyde de carbone et eau). La réaction
chimique est symbolisée par l’écriture d’une équation chimique. Cette dernière s’écrit avec les
nombres stœchiométriques entiers les plus petits possible, ajustés en respectant les règles de
conservation de la matière : CH4 + 2O2 CO2 + 2 H2O
En classes de seconde et de première S, le choix a été fait de ne traiter que les transformations
simples, modélisées par une seule réaction chimique. Les transformations plus complexes, telles la
combustion d’une bougie par exemple, ne peuvent être modélisées par une réaction chimique unique.
Ce n’est qu’à la fin de l’enseignement de terminale scientifique que seront envisagés les cas de
réactions multiples. Par exemple, lors du titrage d’une solution d’hydroxyde de sodium par de l’acide
chlorhydrique avec un indicateur coloré, les ions hydroxyde et l’indicateur coloré réagissent tous deux
avec les ions oxonium de l’acide. Pour manifester visuellement la fin de la réaction de titrage, il faut
que la réaction entre l‘indicateur et l’acide ne “ débute ” que lorsque celle entre les ions hydroxyde et
l’acide est parvenue à son avancement maximal. Cette maîtrise du contrôle des transformations est
au programme de la classe de terminale S.
L’avancement : comment utiliser cet outil pour établir des bilans de matière ?
L’avancement de la réaction est un outil qui permet de “ suivre ” l’évolution du système entre son état
initial et son état final. Considérons par exemple la combustion du méthane, qui se modélise par une
réaction dont l’équation est la suivante : CH4 + 2O2 CO2 + 2H2O
La traduction de cette écriture est simple : elle signifie que la combustion d’une mole de méthane
consomme deux moles de dioxygène et produit deux moles d’eau et une mole de dioxyde de carbone.
La réaction chimique est conçue comme un événement, dont la quantité est mesurable par son
avancement (exprimé en mol). L’avancement de la réaction étant désigné par x, une quantité x de
méthane disparaît avec une quantité 2.x de dioxygène pour donner des quantités x de dioxyde de
carbone et 2.x d’eau. Si l’on considère un récipient, contenant deux moles de méthane qui alimentent
un brûleur, le tableau descriptif de l’évolution de ce système s’écrit :
Équation de la réaction
CH4 + 2O2 CO2 + 2H2O
Quantité de matière dans
l’état initial (mol)
2
6
0
0
Quantité de matière au cours
de la transformation (mol)
2 - x
6 - 2.x
x
2.x
Quantité de matière dans
l’état final (mol)
0
2
2
4
Pour montrer que l’on parvient à l’épuisement de l’un des réactifs, les calculs délicats sur les
proportions stœchiométriques sont remplacés par des soustractions. C’est précisément lorsque le
système a atteint cet état, appelé état final, que l’avancement de la réaction est maximal. Le réactif
épuisé est qualifié de limitant.
Le système peut s’arrêter d’évoluer avant transformation totale des réactifs : l’avancement final de la
réaction est alors différent de son avancement maximal. En classes de seconde et de première S,
toutes les transformations envisagées ne font intervenir qu’une seule réaction chimique, atteignant
toujours l’avancement maximal.

Les concepts introduits en classe de première scientifique
Quels outils d’analyse et de mesure des systèmes ?
La conductimétrie est introduite comme technique de mesure adaptée aux solutions ioniques. Cette
technique est reprise en classe terminale scientifique dans l’enseignement obligatoire et en spécialité.
Elle repose sur le fait que les solutions ioniques sont conductrices et que la conductance d’une portion
de solution dépend à la fois de la nature des espèces ioniques présentes et de leurs concentrations
molaires effectives.
Il est essentiel de ne faire varier qu’un des facteurs à la fois. Par exemple, si l’on suit l’évolution de la
conductance G d’une solution donnée -une solution de chlorure de sodium par exemple- en fonction
de sa concentration molaire c, une relation simple (étalonnage) peut être établie entre G et c, qui
conduit à la possibilité de déterminer la concentration molaire de n’importe quelle autre solution de
chlorure de sodium par exploitation de la relation ou de la courbe d’étalonnage.
On peut aussi travailler à volume quasiment constant dans un système en solution qui est le siège
d’une réaction chimique. Dans ce cas, c’est le remplacement progressif de certaines espèces ioniques
réactives par d'autres espèces (ajoutées ou produites) qui conduit à la variation de la conductance. Un
raisonnement sur l’évolution des quantités de matière ionique au sein de la solution permet de définir
la notion d’équivalence et de réaliser des dosages par titrage.
Ce sont les réactions acido-basiques et d’oxydoréduction qui servent de support à ces titrages. On
introduit expérimentalement et sans développement quantitatif à ce niveau, les notion de couple
acide/base et de couple oxydant/réducteur associés respectivement à des transferts de protons et
d’électrons.
La cohésion de la matière : comment distinguer les différents niveaux ?
Une distinction est faite entre les différents niveaux de cohésion de la matière. Le rôle des interactions
est abordé en première S à plusieurs occasions et illustré par l’expérience. Les molécules sont
construites en respectant des règles d’association entre atomes. L’interaction fondamentale à l’origine
de la liaison covalente est l’interaction électromagnétique. La réaction chimique fait intervenir de fortes
énergies associées à la redistribution des électrons entre les atomes. Ces entités, atomes, molécules
et ions, peuvent se lier avec une énergie plus faible dans les liquides et les solides.
La molécule d’eau, qui possède un dipôle électrique, peut se lier à des ions (solvatation), à d’autres
molécules d’eau (constitution des phases condensées liquides et solides), à d’autres molécules
polaires (solubilité des alcools et des amines). La nature des liens établis entre molécules explique les
différences de température de changement d’état, de solubilité, le comportement hydrophile ou
hydrophobe, la structure des protéines et au-delà leur synthèse (étudiée dans l’enseignement de
biologie). Un second niveau de structuration de la matière apparaît donc, gouverné par des liaisons
moins énergétiques.
La fin du programme de première S suggère d’ailleurs de comparer les ordres de grandeur des
énergies de cohésion dans les molécules -liaisons covalentes- et entre les molécules. Autrement dit
d’expliquer pourquoi il est possible de faire bouillir de l’eau sans en briser les molécules et de séparer
les deux brins de l’ADN sans en briser la chaîne de nucléotides.
Et la chimie organique ?
Comme dans le programme de la classe de seconde, la chimie organique n’apparaît pas
explicitement dans le programme, pas plus que la chimie inorganique, mais elle y est bien présente,
chaque année avec une approche différente. Ainsi, les familles de composés (alcanes, alcènes,
alcools, etc.) ne sont pas introduites par une approche systématique de type monographie ; le vaste
champ de la chimie organique, dans la partie intitulée “ La chimie créatrice ”, est défini à partir de
l’extraordinaire capacité de l’atome de carbone à s’entourer d’atomes d’hydrogène, d’oxygène et
d’azote pour constituer les milliards de molécules qui constituent les êtres vivants
La formule chimique a du sens pour un chimiste, elle est un outil qui permet de rationaliser et de
prévoir des propriétés. Les molécules sont analysées sous l’angle de leur squelette carboné et des
éventuels groupes caractéristiques qui y sont attachés. On montre d’abord l’influence du squelette
carboné et des groupes caractéristiques sur les propriétés physiques (température d’ébullition,
solubilité, densité) avant d’établir que les propriétés chimiques dépendent plutôt du groupe
caractéristique. La notion de famille de composés émerge des relations structure-propriétés.
D’autre part, il est prévu de mettre en évidence sur des exemples simples la stéréoisomérie
géométrique (alcènes de type Z et E). En revanche, on n’envisagera pas au lycée d’étudier la
stéréoisomérie due à l’existence d’un atome de carbone asymétrique. En effet, les programmes de

sciences de la vie abordent simplement la reconnaissance moléculaire par une complémentarité de
structures entre sites actifs et substrats (analogie clef/serrure) et non par les aspects spatiaux liés à la
notion de chiralité.
Le titre de “ chimie créatrice ” illustre bien la diversité des réactions associées aux molécules
carbonées : on montre qu’il est possible de modifier le squelette carboné d’une molécule (l’allonger, le
raccourcir, le cycliser, le ramifier, le déshydrogéner) et de passer d’un groupe caractéristique à un
autre par des réactions d’additions, de substitutions, d’oxydations, notamment sur la famille des
alcools. A partir de matières premières issues de la pétrochimie, la synthèse de molécules d’usage
courant illustre bien ces différentes réactions.
L’importante question : “ Les pétroles, faut-il les brûler, faut-il les transformer ? ” est abordée en fin de
programme par une étude sur l’énergie au quotidien et les enjeux énergétiques. Une réflexion
citoyenne peut être menée sur les produits formés, susceptibles d’interagir avec l’environnement.
C’est l’occasion de faire réfléchir les élèves à la disponibilité des ressources en carburants fossiles, et
de les sensibiliser à l’évaluation des risques.
Les concepts introduits en classe terminale scientifique
En classe de première, on analyse les comportements des systèmes sans préjuger de leur évolution.
L’étude de l’évolution des systèmes chimiques ou biologiques , qui a fait un pas gigantesque au XXe
siècle, est au cœur des enseignements scientifiques de la classe terminale S, que ce soit en chimie,
en physique ou en sciences de la vie et en sciences de la Terre. L’approche proposée est simple,
s’appuyant largement sur des observations expérimentales. Le programme pose des questions très
générales, offrant à l’élève un large champ d’hypothèses et d’interprétations.
Il découvre que les transformations chimiques n’ont pas le caractère rapide et total qu’il entrevoyait
jusqu’alors, problèmes auxquels le chimiste est confronté quotidiennement.
Le programme se décline en quatre grandes questions :
1. Les transformations d’un système chimique sont-elles toujours rapides ?
2. Les transformations d’un système chimique sont-elles toujours totales ?
3. Les transformations ont-elles un sens d’évolution spontanée et si oui, ce sens peut-il être
inversé ?
4. Comment le chimiste peut-il contrôler l’évolution d’une transformation spontanée ?
Dans un premier temps, l’élève découvre les aspects “ contraignants ” de la transformation -elle est
lente, non totale- puis il découvre qu’il est possible de la contrôler : remédier à la lenteur, au faible
rendement, inverser le sens de certaines transformations, travailler avec d’autres réactifs pour aboutir
plus efficacement au même produit. Tout est sujet à une expérimentation raisonnée, ciblée, simplifiée
au maximum, laissant place à l’initiative des élèves et à la démarche par questionnement.
L’expérience doit être intimement liée à la découverte d’un phénomène et doit rester suffisamment
simple pour que l’élève en maîtrise les rouages. L’enseignant, à partir d’une expérience probante,
tente d’éveiller la curiosité, de soulever un débat ou de permettre aux élèves de choisir parmi
plusieurs hypothèses.
1
/
4
100%