Lesson Title: Understanding Isotopes: A Penny for

Parlons Sciences : Plan de cours de l’ANC – Les isotopes
1
Fiche reproductible – Présentation des isotopes – Corrigé
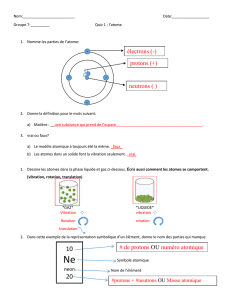
1. Définissez les termes suivants en vos propres mots.
Numéro atomique
Nombre de protons dans un atome de l’élément ___________________ __ _________
Masse atomique
Quantité de matière contenue dans un atome de l’élément exprimée en unités de masse
atomique (u)_____________________________________________________________________
Nombre de masse
Nombre total de protons et de neutrons dans un noyau atomique_____________________
Isotope
Versions d’un élément qui ont dans leur noyau atomique le même nombre de protons mais
des nombres différents de neutrons______________________________________________
2. Calculez le nombre de neutrons dans les deux isotopes du chlore.
Chlore 35 Nombre de masse : 35 Nombre de protons : 17 Nombre de neutrons : 18
(numéro atomique 17)
Calcul du nombre de neutrons : 35 – 17 = 18
Chlore 37 Nombre de masse : 37 Nombre de protons : 17 Nombre de neutrons : 20
(numéro atomique 17)
Calcul du nombre de neutrons : 37 – 17 = 20
3. Si la masse de chaque proton est une unité et que celle de chaque neutron est une unité, pourquoi
toutes les masses atomiques figurant sur le tableau périodique comportent-elles des nombres
décimaux et non uniquement des nombres entiers?
Les réponses varieront.____________________________________________________________

Parlons Sciences : Plan de cours de l’ANC – Les isotopes
2
4. Dans un échantillon donné de chlore, il y a à peu près 75 % d’atomes de chlore 35 et seulement
25 % de chlore 37 (deux seuls isotopes stables du chlore). Quelle sera la masse atomique moyenne
du chlore?
Raisonnement
G – Quelles sont les constantes? Masse atomique et proportion de chaque isotope
35Cl, 75 %; 37Cl, 25 %
Convertir le % en fraction d’isotopes : 75 % = 0,75; 25 % = 0,25
U – Quelles sont les inconnues? Masse atomique moyenne
E – Poser l’équation. Masse atomique moyenne = (35Cl x fraction1) + (37Cl x fraction2)
S – Remplacer les constantes. = (35 x 0,75) + (37 X 0,25)
S – Résoudre. = 26,25 + 9,25
= 35,5
La masse atomique moyenne est de 35,5 u.
L
e
s
i
s
o
t
o
p
e
s
1
/
2
100%