Préparation des anticorps

1
S. I. I.T.U. B.
TECHNIQUES IMMUNOLOGIQUES
PREPARATION D’ANTICORPS
PRINCIPES THEORIQUES
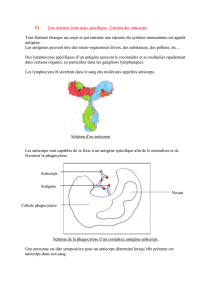
Un anticorps (Ab) est une protéine produite par le système immunitaire et qui peut se
fixer sur une molécule spécifique, généralement une protéine, son antigène (Ag). La
très grande spécificité de la reconnaissance d'un Ag par un Ab et la stabilité de
l'interaction Ag-Ab a fait que des techniques dérivées de l'immunologie ont été
exploitées même pour des études n'ayant rien à voir avec la recherche dans cette
discipline.
Les anticorps sont des protéines de la famille des immunoglobulines (Ig). Dans
l'organisme il existe plusieurs types d'Ig (IgA, IgG, IgM, etc.). Dans les applications
biochimiques on utilise surtout des IgG, des anticorps pouvant se lier à deux
antigènes. Beaucoup moins utilisés, mais ayant un potentiel de développement
intéressant, les IgY sont produits par les oisaux, dont les poules, et se retrouvent dans
les oeufs, éliminant la néccessité de prise de sang.
Pour une discussion plus en profondeur sur la structure des anticorps, on peut se
référer à un bon manuel d'immunologie. Une présentation simple mais relativement
complète de cette information, par D. Wilkinson, est aussi disponible
MÉTHODES ET APPAREILLAGE
De nos jours on se procure généralement les anticorps chez des fournisseurs
commerciaux. Dans certains cas, il faut produire les anticorps soi-même,
particulièrement si on travaille sur des protéines rares ou récemment découvertes. Il
faut tout d'abord immuniser des animaux pour les faire produire des anticorps contre
la protéine sur laquelle on travaille. On peut préparer des anticorps polyclonaux ou
monoclonaux. À partir de cette préparation brute il faut souvent procéder à la
purification de l'anticorps.
La qualité d'une préparation d'anticorps pour des fins de dosages ou d'identification
repose sur deux facteurs principaux, la spécificité et l'avidité (ou affinité). Tout
d'abord, l'anticorps ne doit réagir que contre la protéine d'intérêt pour éviter les
réactions croisées avec d'autres protéines susceptibles de la contaminer, c'est la
spécificité. D'autre part, il doit réagir fortement avec cette protéine et avoir une grande
affinité pour elle, c'est l'avidité.

2
Immunisation des animaux
Certaines espèces sont particulièrement employées pour produire des anticorps: le
lapin, la souris, le rat, la chèvre, le mouton et le cheval. Le choix de l'animal repose
sur divers critères. Si on doit produire beaucoup d'antisérum, on choisit alors un
animal plus gros. cependant les gros animaux sont plus couteux (achat, élevage, etc.)
et sont souvent moins faciles à manipuler. D'autre part, si on veut un animal facile à
manipuler et à élever en laboratoire, on se tournera vers des espèces plus petites. Les
petits animaux comme les rats ou les souris se gardent facilement dans des
installations peu couteuses et sont faciles à manipuler. Cependant, on ne peut pas
prélever de grandes quantités de sang. Des espèces de tailles intermédiaires, comme le
lapin, sont donc souvent employées. La quantité d'antigène disponible est aussi un
facteur très important: plus l'animal est gros, plus il faut d'antigène pour induire une
réponse immunitaire utile.
Quoi qu'il en soit, il est important de choisir un animal qui est phylogénétiquement le
plus éloigné possible de la source de la protéine avec laquelle on veut faire
l'immunisation. En effet, une protéine est d'autant plus antigénique qu'elle ne
ressemble pas à une protéine normalement présente chez l'espèce qu'on veut
immuniser. Ainsi, si on veut préparer un anticorps contre une protéine de rat, on
préférera souvent immuniser un cheval ou une chèvre plutôt qu'un autre rongeur
comme la souris. Tel que mentionné précédemment cependant, les limitations
inhérentes à l'emploi de gros animaux peuvent inciter à se tourner quand même vers
une espèce moins appropriée mais plus facile à élever et à manipuler. Il est aussi
évident qu'on ne peut pas immuniser un animal contre une protéine commune aux
animaux de sa propre espèce! Les souris sont particulièrement employées pour la
production d'anticorps monoclonaux.
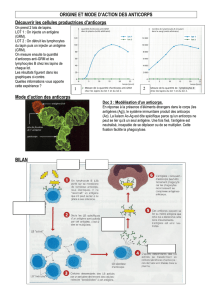
On peut injecter l'antigène de plusieurs façons, l'important est que l'antigène reste le
plus longtemps possible dans l'organisme et arrive dans la circulation sanguine petit à
petit pour maximiser la production d'anticorps. Les principales voies d'administration
sont des injections sous-cutanées, intradermiques, ou intramusculaires; les injections
intraveineuses et intrapéritonéales ne sont employées que dans des cas particuliers.
Pour ralentir la libération de l'antigène dans la circulation sanguine et activer la
réponse immunitaire on combine généralement l'antigène à une émulsion appelée
adjuvant. Le plus connu est sans contredit l'adjuvant de Freund qui est composé
d'huile minérale additionnée d'un agent émulsionnant (adjuvant incomplet) et de
particules de bacille inactivé de la tuberculose (adjuvant complet). Ce type de
procédure avec adjuvant complet est cependant douloureuse pour les animaux et sont
très fortement déconseillées par les organismes de protection des animaux. D'autres
produits sont plus rarement employés comme des sels d'alun, de l'albumine sérique de
boeuf méthylée, etc.
Le système immunitaire produit relativement facilement des anticorps contre les
grosses molécules comme les protéines et les polysaccharides, on qualifie ces
molécules d'immunogènes. Cependant les molécules de petite taille (e.g. hormones
stéroïdiennes, petits peptides, etc.) sont très peu antigéniques. On peut cependant
produire des anticorps contre de petites molécules qu'on appelle alors "haptènes". Il
faut tout d'abord conjuguer ces petites molécules sur des vecteurs ("carriers"), des
protéines comme l'albumine ou l'hémocyanine de patelle (sorte d'invertébré). Ce

3
complexe, une fois injecté chez l'animal induira la formation d'anticorps contre
l'haptène en tant que tel et le vecteur. Après avoir débarrassé les anticorps contre
l'haptène proprement dit de ceux reconnaissant le vecteur, on peut alors utiliser ces
anti-haptènes. C'est de cette façon qu'on peut préparer des anticorps contre certaines
hormones, médicaments ou des petits peptides.
Le sérum contenant l'anticorps recherché est appelé antisérum. Il contient
normalement plusieurs espèces d'anticorps différents (environ une dizaine de
clonotypes) dirigés contre plusieurs épitopes (déterminants ou sites de liaison) du
même antigène, on appelle cette préparation polyclonale. Avec un tel mélange, une
même molécule d'antigène peut fixer en même temps plusieurs anticorps différents,
chacun sur son épitope spécifique. On a développé des techniques permettant d'isoler
et de cloner des lymphocytes ne produisant qu'une espèce moléculaire (i.e. clonotype)
d'anticorps, ces anticorps sont appelés monoclonaux. Ces anticorps ne reconnaissent
qu'un seul épitope de l'antigène.
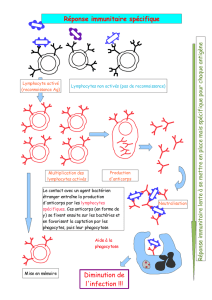
Préparation d'anticorps polyclonaux
Un mélange polyclonal contient plusieurs anticorps reconnaissant plusieurs épitopes
différents d'un même l'antigène. Cela se fait en injectant la protéine d'intérêt à des
animaux de l'espèce choisie. La réponse primaire suit l'activation des lymphocytes T
après la première exposition à l'antigène. Elle est généralement longue, une à deux
semaines, et de faible intensité. Pour augmenter la production d'anticorps, on procède
à d'autres injections, des rappels. Une réponse secondaire résultera alors de l'action
des lymphocytes B. Elle sera alors plus intense et plus rapide. On peut faire plusieurs
rappels pour stimuler la production d'anticorps ou, le cas échéant, la réactiver.
L'antigène est rarement administré seul. Habituellement on le combine à un mélange,
un adjuvant, qui a pour rôle de stimuler la réponse antigénique.
On prélève le sérum de cet animal après qu'il a eu le temps de produire une quantité
suffisante d'anticorps. Le sérum contenant principalement l'anticorps recherché est
souvent appelé antisérum. Évidemment cet antisérum, en plus d'être polyclonal, est
polyvalent. Il contient des anticorps contre toutes les protéines étrangères (virales,
bactériennes) auxquelles l'animal a été exposé plus ou moins récemment. Il devient
alors souvent nécessaire de purifier l'anticorps qui nous intéresse.
Cette technique est relativement peu coûteuse. Cependant la spécificité de l'anticorps
n'est pas nécessairement très forte. Pour éviter que cette préparation ne donne des
réactions croisées, il faut purifier l'anticorps. De plus, pour augmenter la spécificité, il
est essentiel que l'antigène injecté soit le plus pur possible.
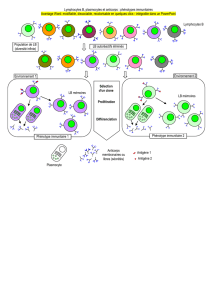
Préparation d'anticorps monoclonaux
Une préparation d'anticorps monoclonal contient une seule espèce d'anticorps
(clonotype) ne reconnaissant qu'un seul épitope de l'antigène. Pour obtenir une telle
préparation, on injecte tout d'abord l'antigène à une souris. Après quelques jours, la
rate contiendra un grand nombre de lymphocytes B produisant divers clonotypes. Les

4
lymphocytes B ne peuvent pas proliférer dans des cultures de cellules in vitro. Ces
lymphocytes B de la rate peut quand même être isolée et fusionner avec des cellules
de myélome, qui sont des cellules transformées, donc des lignées immortelles qui
peuvent être maintenues indiniment en culture. Les cellules résultant de cette fusion
sont souvent appelées hybridomes.
Les souches de myélome utilisées doivent être des mutants n'ayant pas, soit la
thymidine kinase (TKase), soit la HGPRTase, deux enzymes nécessaires à la
biosynthèse de novo des nucléotides. Ces cellules ne peuvent se développer et se
multiplier qu'en produisant des nucléotides par les voies métaboliques de récupération
des nucléotides. Ces voies sont inhibées par des antagonistes de l'acide folique comme
l'aminoptérine. Ces myélomes mutants meurent dans un milieu contenant de
l'aminoptérine ou tout antagoniste de l'acide folique parce qu'ils sont incapables de
biosynthétiser des nucléotides. En effet l'aminoptérine bloque la biosynthèse des
nucléotides via les voies métaboliques de récupération ("salvage pathways") et la
mutation empêche le fonctionnement des voies de novo. Le milieu contient aussi de la
thymidine et de l'hypoxantine, les deux bases azotées qui les points de départ des
voies de récupération.
Le résultat de la fusion donnera un mélange contenant alors trois types de cellules.
Tout d'abord, il y a les cellules de rate non fusionnées qui produisent des anticorps,
mais qui sont incapables de croitre in vitro. Ensuite, il y a les cellules transformées
non fusionnées qui sont capables de se multiplier mais sont inhibées par
l'aminoptérine. Enfin, il y a des hybridomes, les cellules résultant de la fusion des
cellules transformées et des lymphocytes. Les hybridomes sont capables de se
multiplier indéfiniment car ils possèdent le génome des cellules transformées. De
plus, comme ils possèdent aussi le génome des lymphocytes, les hybridomes sont
capables de biosynthétiser des nucléotides par la voie de récupération en utilisant la
thymine et l'hypoxanthine du milieu. Donc seuls les hybridomes seront capables à la
fois de proliférer dans ce milieu et de produire des anticorps. Evidemment la plupart
des hybridomes ne produisent pas l'anticorps recherché, ils faut alors procéder à un
criblage pour les isoler et les cloner.
Pour isoler des clones ne produisant qu'une seule espèce d'anticorps, on a recourt à la
technique des dilutions limites. On dilue les hybridomes à une concentration très
faible. On prépare des cultures avec de très petits volumes. La dilution limite fait en
sorte que les probabilités que ce très petit volume contienne deux cellules sont
extrêmement faibles. On est donc quasi assuré que les cellules obtenues dans chaque
culture ne proviennent que d'une seule cellule initiale; ce sont donc des clones purs
qui. évidemment, ne produisent qu'un seul clonotype d'anticorps. Les clones
produisant un anticorps adéquat peuvent à ce moment être identifiés. La dilution
limite peut être répétée sur les clonotypes pour s'assurer que la lignée cellulaire est
vraiment pure. Le rendement de cette méthode est évidemment très faible, et une très
faible fraction des hybridomes produiront un clonotype contre l'antigène.
Ces clones doivent être alors l'objet de cultures massives pour produire des quantités
suffisantes d'anticorps. Même si ces cultures massives peuvent être faites in vitro,
elles sont cependant plus souvent faites in vivo. Pour cela, on injecte ces cellules dans
l'abdomen d'autres souris où elles proliféreront sous forme d'ascites. Ces ascites
sécréteront des anticorps dans la cavité péritonéale de ces souris.Ces anticorps

5
pourront ensuite être récupérés en prélevant le liquide ascitique.
Ces techniques sont très couteuses en terme d'installations, de réactifs, de temps et de
main-d'oeuvre. Les anticorps obtenus sont cependant extrêmement spécifiques.
Cependant, comme cette spécificité ne dépend que d'un seul épitope, les anticorps
monoclonaux se fixent aussi fortement sur toute protéine contaminante contenant "par
hasard" cet épitope. De plus, les techniques immunochimiques nécessitant la
formation de précipitine ou de gros complexes anticorps-antigène sont inutilisables
avec des anticorps monoclonaux.
Purification des anticorps
Dépendant de l'usage prévu, on emploiera des préparations plus ou moins purifiées
d'anticorps. Certaines applications n'exigent qu'un antisérum, d'autres nécessiteront
des anticorps purs, mais la plupart auront des exigences entre ces deux extrêmes.
La technique de purification la plus souvent employée est la chromatographie
d'affinité. Mais avant, on peut procéder à une séparation brute des Ig des autres
protéines sériques (albumine, transferrine, etc.) par précipitation différentielle au
sulfate d'ammonium. Une chromatographie d'échange ionique est aussi possible,
quoique moins employée.
De plus en plus, on procède par chromatographie d'affinité avec la protéine A ou la
protéine G comme ligand pour la région constante des anticorps (Fc). Ce sont des
protéines de source bactérienne ayant la capacité de se fixer sur la région Fc des
anticorps. Une protéine récemment découverte, la protéine L, se liant aux chaînes k de
certaines classes d'anticorps, devient de plus en plus populaire.
Ensuite, pour purifier l'anticorps spécifique, on peut procéder à une chromatographie
d'affinité avec l'antigène comme ligand. Seul l'anticorps contre cette protéine devrait
s'attacher sur la colonne, toutes les autres protéines du sérum étant lavées dans l'éluat.
On peut aussi utiliser des "peptides artificiels" ressemblant à certains épitopes
particulièrement antigéniques de l'antigène (ligands peptidomimétiques).
Il ne reste qu'à désorber l'anticorps qui est à ce moment pratiquement pur.
Les colonnes de chromatographie classiques sont aussi en voie d'être remplacées par
des billes magnétisées de résine sur lesquelles est lié le ligand choisi. Le gros
avantage de cette approche est la rapidité de séparation. Plutôt que de laisser percoler
divers tampons à travers une colonne, on peut facilement récupérer les billes
magnétisées (et ce qui est lié dessus) avec un aimant....
1
/
5
100%