Chapitre 1 : vue d`ensemble du système immunitaire

1
Chapitre 1 : vue d’ensemble du système immunitaire.
L’organisme est soumis à des agressions de type biologiques, chimiques
(usines,…) ou physiques (rayons solaires).
Les agressions biologiques
Peuvent être des virus, des bactéries, des parasites ou des éléments
inertes (pollen). Ceux-ci ne sont pas pathogènes à la base, mais peuvent
donner lieu à des réactions allergiques (réponse immunitaire
inappropriée).
Les virus et les bactéries ne fonctionnent pas de la même façon.
Les bactéries sont des organismes à part entière qui se suffisent à elles-
mêmes. Il faut noter qu’elles ne sont pas toutes pathogènes et que
certaines sont indispensables à notre métabolisme (flore).
Les virus, par contre, sont obligatoirement des parasites. Cela veut dire
qu’ils doivent se servir d’un organisme hôte pour pouvoir vivre.
Suivant la nature du pathogène, le système immunitaire adoptera une
réponse appropriée.
Comment l’organisme se défend-il contre les agents infectieux ?
Il existe deux types d’immunités qui n’ont pas la même spécificité ni la
même vitesse.
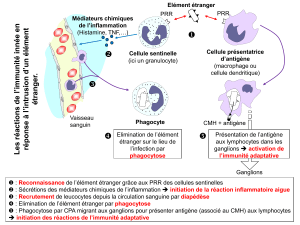
L’immunité naturelle ou innée.
Elle est activée très rapidement (0-4h après l’infection) et constitue notre
première ligne de défense.
Elle permet la présentation des antigènes aux lymphocytes et est
indispensable pour l’activation de la réponse adaptative.
L’immunité acquise ou adaptative.
Elle est activée plus tardivement (plus de 96h).
Elle comprend deux types d’actions :
- l’immunité humorale qui permet la défense contre les pathogènes
extracellulaires (bactéries, toxines, stades précoces de certaines infections
virales). Elle permet l’activation des anticorps.
- l’immunité à médiation cellulaire qui constitue une défense contre
les antigènes endogènes (intracellulaires) comme les virus, les bactéries
intracellulaires et les cellules cancéreuses.
En général…
Le mode de fonctionnement des deux types d’immunités est différent :
Pour l’immunité naturelle, les agents pathogènes seront reconnus par des
effecteurs « non spécifiques ». Ceux-ci peuvent reconnaître si l’antigène
est de type bactérien ou viral mais seront incapables de distinguer deux
types de bactéries.
L’immunité acquise est plus spécifique : après l’infection, l’antigène est
transporté vers les organes lymphoïdes secondaires (rate, glande

2
lymphoïde,…) puis sera reconnu par des lymphocytes T naïfs. Ceux-ci se
divisent de façon clonale et permettent la disparition de l’agent infectieux.
Il faut bien comprendre que les deux types d’immunités agissent de paire
dans la réponse immunitaire : l’immunité naturelle enclenche l’immunité
adaptative. En présentant les éléments étrangers à l’immunité acquise elle
définit la nature de celle-ci (réponse humorale ou à médiation cellulaire).
De même, l’immunité adaptative va renforcer l’action de la réponse innée.
Sans immunité naturelle, la quantité des microorganismes ne serait pas
du tout freinée.
Sans immunité acquise, il n’y aurait qu’un léger retardement de la
croissance des microorganismes (figure dia 8).
Au cours de l’évolution, la réponse adaptative apparaît après la réponse
innée et est propre aux vertébrés.
L’immunité naturelle ou innée
Elle est présente tout au long de l’évolution (ancestrale).
Son mode d’action est « non spécifique » et stéréotypé (sa réponse
sera toujours la même malgré l’infection d’un pathogène récidiviste).
Elle limite l’infection avant l’induction et l’action efficace de la réponse
immunitaire adaptative et permet l’activation et le contrôle de celle-ci.
NB : elle suffit si l’agent infectieux n’est présent qu’en petite quantité.
Elle est la première ligne de défense caractérisée par
-des barrières passives :
Qui peuvent être anatomiques (peau, muqueuses,…) ou physiologiques
comme la température, le PH, l’environnement microbiologique et les
médiateurs chimiques. Ceux-ci peuvent être des lysozymes (présents dans
les muqueuses et les larmes) qui clivent la paroi des bactéries, des
interférons et des compléments (solubles dans le sang).
-des barrières actives :
On retrouve les barrières cellulaires qui permettent la phagocytose des
éléments infectieux (macrophage), ainsi que les cellules à médiateurs qui
exocytent le contenu de leurs granules dans le milieu (histamine,
enzymes,…) et les cellules « natural killer » (NK).
- des barrières inflammatoires :
Caractérisées par une rougeur et un gonflement (œdème).
L’inflammation se déroule en plusieurs étapes :
1. la reconnaissance d’un pathogène par un macrophage au niveau des
protéines membranaires, induit une libération de cytokine.

3
Celle-ci a des propriétés particulières, notamment l’augmentation de la
perméabilité des capillaires, la vasodilatation ainsi que l’attraction des
monocytes (chimiotaxie).
2. la vasodilatation des capillaires provoque une rougeur et un
gonflement.
3. l’augmentation de la perméabilité permet une accumulation de liquide
et de cellules à l’endroit infecté ce qui provoque un œdème.
4. l’afflux de phagocytes vers les tissus permet la phagocytose des
pathogènes et la libération d’enzymes lytiques. S’ensuit une accumulation
de cellules mortes (pus).
L’immunité naturelle peut reconnaître des signaux de dangers (7) :
- les endotoxines
- la mannose des parois bactériennes
- l’ADN bactérien
- l’ADN et ARN viral
- les cytokines
- les dérivés réactifs de l’oxygène (radicaux libres)
- le matériel nécrotique (cellules mortes par nécrose)
NB : la nécrose est la mort subite et accidentelle de la cellule. Celle-ci
explose et libère ses composants dans le milieu comme des dérivés de
l’oxygène (peroxysomes) ou des enzymes hydrolytiques (lysosomes)
inflammation.
L’apoptose est une mort programmée qui ne constitue pas de danger pour
l’organisme (corps apoptotiques).
L’immunité naturelle est non spécifique mais elle permet une
reconnaissance de structures microbiennes hautement conservées
(PAMPs). Celles-ci sont produites par les microorganismes et non pas par
les cellules hôtes (extracellulaire).
Elles sont essentielles à la survie du pathogène et donc conservées au
cours de l’évolution.
Ce sont des signatures moléculaires d’une classe de pathogène (ex :
peptidoglycanes, lipopolysaccharides,… pour toutes les bactéries).
Les PAMPs sont reconnus par des récepteurs : les PRRs.
Il existe plusieurs familles de récepteurs, dont les récepteurs TOLL.
Ceux-ci sont des protéines intra membranaires ancestrales.
Ils sont présents chez la drosophile et possèdent des homologues chez les
plantes.
Ils peuvent s’associer en dimère.
Mode d’action :
1. le pathogène se fixe au récepteur
2. modification du récepteur qui active des protéasomes qui dégradent
l’IKB.
La IKB est l’inhibitrice du complexe protéique NF-KB. Le trimère est au
repos.

4
3. Lorsque l’IKB est détruite, le complexe NF-KB est activé.
4. Le NF-KB migre vers le noyau est active un gène promoteur qui code
pour la cytokine.
5. inflammation.
Les NOD sont des récepteurs cytoplasmiques qui reconnaissent des
éléments étrangers qui sont entrés dans la cellule.
Pour résumer, les caractéristiques des récepteurs de la réponse
innée (5) sont :
- une spécificité « héritée » (réaction avec pathogène sans modifications)
>< distribution clonale.
- expression à la surface de toutes les cellules de même nature (même
récepteurs sur les cellules de même nature).
- induction d’une réponse immédiate (NF-KB).
- codés par un seul gène.
- reconnaissance d’une large gamme de pathogènes (pas de précision).
L’immunité acquise ou adaptative.
Elle est capable de distinguer le soi et le non soi.
Elle reconnaît un danger spécifiquement (type de bactéries, type de
virus,…) et est dotée de mémoire.
Elle est autorégulée.
Les cellules qui constituent cette réponse adaptative peuvent agir sur des
éléments extracellulaires (toxines bactéries) et font dès lors partie de la
réponse humorale, ou sur des éléments intracellulaire (protéines
virales) et constitueront la réponse à médiation cellulaire.
Les cellules de la réponse humorale sont principalement des lymphocytes
B capables de produire des anti-corps après présentation d’un fragment
du pathogène par un macrophage (activation par l’immunité innée).
Les cellules de la réponse à médiation cellulaire sont des lymphocytes T
(de type auxiliaires ou cytolytiques).
Les lymphocytes Th sont particuliers car ils activent spécifiquement l’une
ou l’autre cellule du système immunitaire (macrophage, B, Tc) : ils sont
dits « chefs d’orchestre ».
Les caractéristiques des récepteurs sont très différentes de la réponse
innée :
- ils sont codés par de nombreux gène (réarrangements génétiques)
- ils font l’objet d’une distribution clonale : un même type de cellule
possède des récepteurs différents pour permettre une grand spécificité
dans la reconnaissance du pathogène. La reproduction de ces cellules se
fait de façon clonale.
Pour résumer, la réponse adaptative constitue une réponse sur mesure,
c’est-à-dire qu’elle peut reconnaître des cellules du NON SOI par des
récepteurs spécifiques et réalise une prise de conscience de cette

5
reconnaissance par transmission de signaux. Il y a donc une mise en jeu
de molécules ou de cellules chargées d’éliminer l’intrus.
Elle est aussi dotée de mémoire.
L’efficacité de la réponse adaptative dépend d’un système approprié de
reconnaissance et de présentation des structures étrangères ainsi que de
la possibilité d’interactions entre les cellules présentatrices et les cellules
du système immunitaire.
Les cellules qui interviennent sont détaillées au chapitre deux.
Résumé du chapitre :
IMMUNITE INNEE
IMMUNITE ADAPTATIVE
Réponse très rapide
Réponse lente
Réponse stéréotypée
Réponse variée et adaptée au
pathogène
Efficacité limitée et constante
Efficacité croissante avec le temps
Mémoire
Chapitre 2 : cellules et organes du système immunitaire.
Organes lymphoïdes
Ils sont le lieu de production et de maturation des cellules immunitaires
et peuvent être primaires ou secondaires.
Les organes lymphoïdes primaires sont la moelle osseuse et le thymus.
La moelle osseuse renferme des cellules souches capables de se
différencier en n’importe quelles cellules du sang et principalement des
lymphocytes B. Elle produit également des Lymphocytes T immatures qui
vont ensuite migrer vers le Thymus pour acquérir leurs récepteurs
spécifiques.
Les organes lymphoïdes secondaires sont les ganglions lymphatiques,
l’appendice, les vaisseaux lymphatiques, la rate, les amygdales,…
Ils sont responsables des interactions entre les lymphocytes matures
et les antigènes provenant des tissus périphériques (site de rencontre).
Organe lymphatique primaire : le thymus.
C’est le lieu de maturation et de sélection des lymphocytes T.
Les cellules stromales (architecture : fibroblastes,…) exprimant un taux
importants de molécules CMH I ou II ont un rôle important.
Le thymus permet l’élimination par apoptose (95 à 99%) des cellules
incapables de reconnaître des cellules du SOI et ayant une trop grande
affinité pour les antigènes du SOI. Les cellules incapables de reconnaître
le CMH (car récepteur TCR inapproprié) sont donc apoptosées.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%