UE8-Roquebert-Herpesviridae (word)

1/25
UE8 – De l’agent infectieux à l’hôte
Dr Bénédicte ROQUEBERT
Date : 18/04/2016 Plage horaire : 16h15-18h15
Promo : P2 2015/2016 Enseignant : Dr Bénédicte Roquebert
Ronéistes : MASSIP Chloé
JACQUENOD Enzo
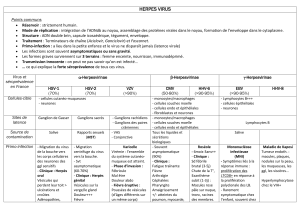
Herpesviridae
I. Introduction
1. Classification
2. Propriétés des HERPESVIRIDAE
II. Herpès simplex virus 1 et 2 (HSV-1 et HSV-2)
1. Epidémiologie
2. Physiopathologie (Non traitée 2015/2016)
3. Pouvoir pathogène chez l’Homme
4. Diagnostic biologique
5. Traitement
III. Virus varicelle zona (VZV)
1. Epidémiologie
2. Pouvoir pathogène
3. Diagnostic biologique
4. Traitement
IV. Epstein-Barr Virus (EBV)
1. Epidémiologie
2. Pouvoir pathogène
3. Diagnostic biologique
V. Cytomégalovirus (CMV)
1. Epidémiologie
2. Pouvoir pathogène
3. Diagnostic biologique
4. Traitement
VI. Human herpes virus 6 et 7 (HHV6 et HHV7)
VII. Human herpes virus 8 (HHV8)

2/25
I. Introduction
1. Classification
Les Herpesviridae font partis d’un ordre viral : les Herpesvirales.
La famille des Herpesviridae comprend une centaine d'espèces dont seulement 8 qui infectent l'homme et
appartiennent à 3 sous-familles :
Alphaherpesvirinae : Human Simplex Virus 1 et 2 (HSV-1 et HSV-2), Varicelle Zona Virus (VZV)
Betaherpesvirinae : Cytomegalovirus (CMV), Human Herpes Virus 6 et 7 (HHV6 et HHV7)
Gammaherpesvirinae : Epstein Barr Virus (EBV), Human Herpes Virus (HHV8)
Ce schéma représente les différentes sous-familles des Herpesviridae (les genres ne sont pas à savoir) :
2. Propriétés des HERPESVIRIDAE
A. Structure et composition
Les Herpesviridae ont tous :
la même morphologie (on ne peut pas les différencier en
microscopie électronique)
une taille comprise entre 150 et 200 nm de diamètre
une enveloppe (provenant de la cellule hôte) donc ils sont
fragiles car la capsule est un facteur de fragilité.
un ADN double brin linéaire (= ADN bicaténaire linéaire)
codant pour un grand nombre de protéines (supérieur à 100
gènes)
une capside icosaédrique (forme d’une petite sphère)
un tégument spécifique (constitué de plusieurs protéines virales indispensables à la réplication)
Ces herpès virus peuvent entraîner deux types d'infections :
soit une infection productive lytique, caractéristique de la primo-infection, on aura une production des

3/25
virus et une destruction cellulaire.
soit une infection non productive latente : il n’y a pas de production de virus et non symptomatique.
Leur composition de l’extérieur vers l’intérieur :
1) les glycoprotéines virales de l’enveloppe
2) la bicouche lipidique (d’origine cellulaire) de
l’enveloppe, dans laquelle sont implantées les
glycoprotéines virales
3) le tégument
4) la capside icosaédrique (très bien structurée avec un
nombre de face par exons et par pentons qui est, pour
les Herpesvirus, de 16 faces à chaque fois. Donc, c’est
très géométrique).
5) A l’intérieur de cette capside, on a l’ADN bicaténaire
linéaire qui a une taille variable en fonction des
Herpesvirus : de 125 000 pdb (VZV) à 230 000 pdb
(pour le CMV qui a le plus gros génome).
Ronéo 2014/2015 (Non traité 2015/2016)
Ils sont caractérisés par des protéines importantes (protéines-clés) :
Au niveau du tégument (il y en a 2) :
la protéine transactivatrice VP16
rôle important dans le déclenchement de la réplication virale
la protéine VHS
inhibe tout le métabolisme de la cellule
Ronéo précédent : Les organismes les plus solides sont ceux qui sont le plus inhibés.
Ceux qui peuvent survivre sont les plus simples contrairement aux organismes sophistiqués. Ici deux
protéines suffisent pour bloquer l’ensemble des mécanismes de la cellule.
Au niveau des glycoprotéines d’enveloppe (il y en a 11) :
GP C permet l’attachement du virus aux héparanes sulfates des cellules
GP D : rôle de ligand la protéine va être reconnue par les récepteurs cellulaires.
La fusion nécessite au moins 4 GP (B, D, H, L)
GP B et D sont inductrices de la production d’anticorps neutralisants
B. Cycle de réplication virale
Il y a plusieurs phases successives de réplication pour le virus des herpès : une phase très précoce, une
phase précoce et une phase tardive.
Et, ce sont ces phases qui expliquent la latence de ces virus, qui ne vont synthétiser que certains gènes et
certaines protéines pour leur permettre de rester à l’état latent dans les cellules cibles et ce, sans
intégration de leur ADN dans le génome cellulaire (contrairement au VIH).
En effet, le VIH reste à l’état latent dans des sanctuaires, dans les lymphocytes latents, grâce à son
intégration dans l’ADN cellulaire.

4/25
En latence, les Herpesvirus ne vont répliquer qu’une seule des phases qui vont leur permettre de rester
présents dans l’organisme infecté.
Il existe donc une stratégie commune de réplication :
1) Attachement des glycoprotéines virales de l’enveloppe sur les récepteurs des cellules cibles (ces
récepteurs ne sont pas tous les mêmes pour les différents Herpesvirus)
2) Fusion de l’enveloppe du virus et de l’enveloppe cellulaire et lyse de cette enveloppe cellulaire
3) Libération de la nucléocapside (= tout ce qui concerne les protéines structurales de l’intérieur du
virus avec en plus l’ADN) au niveau du Golgi et du réticulum endoplasmique
4) Migration de la nucléocapside via les microtubules cellulaires jusqu’au noyau
5) Pénétration du génome viral dans noyau
6) Circularisation de l’ADN dans le noyau (l’ADN était linéaire)
7) 3 phases de réplication dans le noyau de la cellule infectée (grâce à l’ARN polymérase II qui va
permettre la synthèse des premières protéines et à la polymérase du virus lui-même qui intervient
ensuite)
8) Retour des protéines vers le noyau
9) Bourgeonnement à partir de la membrane nucléaire (avec ancrage des glycoprotéines virales dans
l’enveloppe nucléaire) et encapsidation/décapsidation dans le RE et le Golgi
10) Libération de nouveaux virions (par exocytose) après passage dans l’appareil de Golgi (où il y
aura des phénomènes d’enveloppement comme la phosphorylation pour finaliser les virus)
Ces virus ont un cycle de réplication relativement court (18-20h) lytique (qui se termine par
l’éclatement de la cellule).

5/25
Schéma de la ronéo de l’année dernière (2014/2015) :
La synthèse des protéines virales des Herpesviridae (NON TRAITE en 2015/2016)
Nécessite l’interaction de VP 16 avec la protéine cellulaire transactivatrice oct-1 permet l’initiation
de la transcription puis la synthèse des protéines virales en 3 vagues :
1) 5 gènes « très précoces » à l’origine des protéines très précoces (protéines IEA = Imediate
Early Antigens) transactivatrices dont le rôle est de se fixer sur le génome pour induire
transcription et traduction des protéines 2e vague
2) 2 protéines très précoces (ICP 4 et ICP 27) activent l’expression des gènes « précoces » qui
codent les protéines enzymatiques (protéines EA = Early Antigens) impliquées dans la
réplication du génome viral (on a l’ADN polymérase, la thymidine kinase)
3) Protéines tardives de structure constitutives du virus (protéines LA = Late Antigens),
c’est-à-dire les protéines de capsides qui s’assemblent dans le noyau.
Caractéristique des herpes virus : Une traduction protéique en 3 phases + transactivation de la
première phase sur la deuxième !
C. Infection latente
Après primo-infection, les Herpesvirus persistent A VIE dans l’organisme, sous forme « dormante ».
Sites différents de latence selon les sous-familles des herpès.
Réactivations de l’infection à l’origine de réinfections endogènes excrétions intermittentes du virus.
On peut avoir le virus sans s’en rendre compte et l’excréter (aussi bien de l’HSV que du CMV), sans que
cela soit symptomatique.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
1
/
25
100%