Mitose et Cycle Cellulaire

Mitose et Cycle Cellulaire
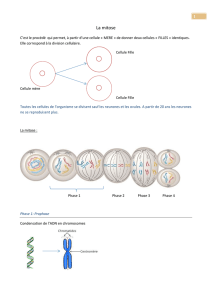
Mitose
La mitose traduit la séparation exacte de tout le matériel génétique de la cellule en deux
parties égales.
Dans une cellule en interphase, on ne voit rien. On voit quelque chose lors de la compaction
de la chromatine et de la mise en place des fuseaux mitotiques de microtubules.
La mitose est divisée en différentes phases :
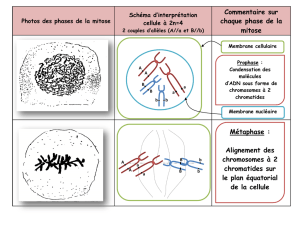
Prophase
- début de condensation des chromosomes --> phosphorylation des histones
- les chromosomes ont été dupliqués : les 2 chromatides sont accrochées par un centromère
- les centrioles sont dupliqués et se dirigent dans une direction diamétralement opposée pour
obtenir une symétrie bilatérale : deux pôles
- début de la formation du fuseau mitotique à partir des centrioles
- la membrane nucléaire est toujours en place
Prométaphase
- phase la + longue
- mouvement important des chromosomes
- rupture de la membrane nucléaire --> phosphorylation des lamines
- les chromosomes se dispersent dans le volume de la cellule
- les chromosomes s’accrochent aléatoirement à des microtubules au niveau de leurs
kinétochores, placés latéralement par rapport au centromère central
- les microtubules forment le fuseau mitotique
Métaphase
- phase la + courte.
- les chromosomes migrent pour se placer dans un plan médian (=plaque métaphasique ou
équatoriale) perpendiculaire par rapport au grand axe du fuseau mitotique.
Anaphase
Deux phénomènes simultanés pour aboutir à la ségrégation complète des deux lots de
chromatides vers un des pôles du fuseau grâce aux protéines motrices existant dans le
cytosol : kinésine et dynéine.
--> Anaphase A :
- libération importante d’ions calcium dans le cytosol --> dissociation des centromères et
séparation des chromatides
- les fibres kinétochoriales du fuseau sont constituées de tubulines qui se polymérisent et
dépolymérisent constamment. Elles permettent de réguler la vitesse de migration : si la
concentration de calcium augmente, la vitesse de dépolymérisation diminue et on observe un
raccourcissement des microtubules --> traction des chromatides vers les pôles.

--> Anaphase B :
- allongement important des autres fibres du fuseau mitotique (les fibres polaires) ce qui
éloigne les 2 pôles au maximum. Les 2 lots de chromatides sont donc très séparés.
Télophase
- décondensation progressive de la chromatine --> déphosphorylation des histones
- reconstitution de la membrane nucléaire --> déphosphorylation des lamines (sous la mb
nucléaire et phosphorylées lors de la prophase).
Cytodiérèse
- matérialisation de la fin de la mitose : on obtient 2 cellules filles génétiquement identiques à
la cellule mère.
- au niveau de la plaque métaphasique, pincement du cytoplasme jusqu’à rencontrer les fibres
subsistantes du fuseau mitotique, à l’aide d’un anneau contractile (actine)
Les organites intracellulaires se répartissent au hasard, de manière à peu près égale, mais
sans soucis d’équité parfaite.
Au contraire, il y a une répartition parfaitement exacte du matériel génétique.
Cycle Cellulaire
Le cycle cellulaire correspond à l’espace-temps nécessaire pour aller d’une mitose à une
autre.
La mitose est le point culminant du cycle cellulaire, la chromatine est condensée -->
inactivation génique.
Au contraire, lors de l’interphase ont lieu des évènements biochimiques et structuraux, les
gènes sont accessibles --> synthèses pour préparer la mitose.
Il existe un processus de régulation pour le sens du cycle cellulaire et le nombre d’étapes.
- Pool prolifératif : ensemble des cellules qui parcourent activement le cycle cellulaire
- Pool non prolifératif (phase Go) : cellules qui vont mourir (apoptose) ou cellules
hyperspécialisées qui ne se diviseront plus et arrêtent le cycle cellulaire

Les différentes phases
--> Phase S :
- duplication de l’ADN et du génome
- synthèses de quelques protéines : les histones.
Entre les mitose et la phase S --> insertion d’intervalles (des Gap) : phases G1 et G2.
--> Phase G1 :
- avant la phase S de duplication.
- grande phase de biosynthèse et de transcription de l’ADN en ARN.
- dans le cytoplasme, synthèse importante de protéines nécessaires à la réplication (enzymes ;
ex : ADN polymérases) et la préparation de la mitose (protéines du cytosquelette ; ex :
tubuline, kinésine, dynéine)
--> Phase G2 :
- après la phase S de duplication
- préparation à la mitose
- début de la condensation de la chromatine
- baisse de la transcription et de la synthèse protéique.
- augmentation du volume cellulaire
- augmentation de la taille des organites intra-cytoplasmiques
ADN et histones
--> noyau interphasique
Une molécule d’ADN = un chromosome = 50 à 250.106 paires de NT = +/- 5cm de long
Donc dans le noyau, 46 chromosomes --> 2m de long dans un noyau de quelques microns de
diamètre. Par conséquent, la molécule d’ADN n’est jamais complètement dépliée même sous
forme de chromatine (=ADN + histones)
1 chromosome métaphasique = 10 m --> condensation d’environ 5000 fois grâce aux
protéines d’empaquetage : les histones.
--> chromatine interphasique
C’est une succession de nucléosomes : ADN enroulé autour d’un complexe protéique
d’histones --> 2 tours et demi autour du cœur protéique
Nucléosome = octamère d’histones
- deux dimères (H2A–H2B)
- un tétramère (H3–H3–H4–H4)
Les nucléosomes sont séparés les uns des autres par de l’ADN non enroulé internucléosomal
porteur de l’histone H1.
Les histones sont des protéines très basiques (riches en Lys et Arg) et acétylées. L’état
d’acétylation rend compte de l’accessibilité de l’ADN.
Plus la chromatine est hyperacétylée, plus les histones sont éloignés, et plus les gènes sont
accessibles, ce qui permet la transcription.
Les histones sont synthétisés au moment de la phase S, en même temps que la duplication :
la synthèse des histones et de l’ADN sont synchronisés.

Protéines nucléaires
--> protéines histones
Nucléosome : H2A, H2B, H3 et H4
H1 lié à l’ADN internucléosomal
--> protéines histones
Les protéines non histones sont majoritairement des enzymes :
- topoisomérase II (phosphoryle H1)
- condensine (phosphoryle H3)
- cohésine
- protéines centromériques
- Aurora B
- INCENP : protéine interne du centromère, appartient aux kinésines
- survivine : rôle dans l’apoptose
- protéines motrices
- kinésines
- dynéines
Les protéines de maintenance strucurale (protéines SMC) appartiennent aux protéines non
histones et aident à la compaction de la chromatine, en plus des histones (ex : condensine et
cohésine).
Avant la condensation, action d’une protéine SMC pour démêler la chromatine, puis :
- action de la topoisomérase II, enzyme qui phosphoryle les histones H1 pour rapprocher les
nucléosomes les uns des autres.
- action de la condensine, SMC qui renforce la compaction de la chromatine en phosphorylant
d’autres protéines (ex : active la topoisomérase II)
La phosphorylation des histones s’enchaîne en cascades de réactions.
La topoisomérase II est active pendant tout le cycle cellulaire alors que la condensine
apparaît en fin de prophase et disparaît en fin d’anaphase. Elles ont la même localisation
axiale sur les chromatides sœurs.
Centromère et kinétochore
Le chromosome est constitué de deux chromatides unies par un centromère (fraction
d’ADN hautement répétitive d’environ 170 NT, spécifique de chaque chromosome).
Le centromère est une zone d’accrochage du chromosome à la matrice nucléaire et qui
accroche les protéines non histones spécifiques (ex : topoisomérase II).
Le kinétochore est associé au centromère, c’est un complexe protéique trilamellaire
(Aurora B, INCENP et survivine) qui joue un rôle dans l’accolement et la dissociation des
chromatides, lors de la métaphase.
Son existence est temporaire, de la fin de la prophase jusqu’à la métaphase.

Les protéines kinétochoriales permettent :
- phosphorylation des histones (H3)
- compaction de la chromatine
- capture des extrémités positives des MT, grâce à la dynéine et aux protéines internes du
centromère l’extrémité négative des MT s’accroche au niveau des asters). Un kinétochore
capture de 20 à 40 MT.
- ségrégation des chromatides
Lors de l’anaphase, les chromatides glissent le long des fibres fusoriales en étant
entraînées par les protéines motrices (dynéine et kinésine).
Les deux chromatides sont fermement unies l’une à l’autre par la cohésine qui les maintient
cohésives pour qu’elles ne se séparent pas trop tôt. Cette ségrégation est sous la dépendance
de la formation correcte du fuseau et de la bonne disposition des fibres fusoriales.
Fuseau mitotique
Dans un noyau interphasique, le centrosome (=2 centrioles perpendiculaires) se duplique
pour donner deux asters migrant aux deux pôles diamétralement opposés.
Autour des centrosomes, les MT sont plus ou moins stables et donnent 3 types de fibres :
- MT astériens
- MT kinétochoriens
- MT polaires
La capture des fibres kinétochoriales par les chromosomes est difficile à réaliser, ce qui
explique la longueur de la prométaphase.
Les accrochages incorrects ou inadéquats doivent être défaits puis refaits. Il existe un
point de contrôle qui entraîne l’arrêt de la mitose jusqu’à ce que les chromosomes aient un
accrochage parfait, amphitélique (chaque masse kinétochoriale est accrochée à chaque
chromatide sœur qui a capté un MT associé à chaque aster. La mitose peut alors reprendre.
L’accrochage a lieu grâce aux protéines non histones : Aurora B coopère avec l’INCENP
pour favoriser l’accrochage, tandis que la cohésine unit les 2 chromatides sur toute leur
longueur.
Point de surveillance métaphase – anaphase
La cohésine unit les 2 chromatides sur toute leur longueur depuis la réplication jusqu’à la
métaphase/anaphase où les deux lots de chromatides se séparent.
Prophase et métaphase --> élimination de toutes les molécules de cohésine qui unissent les
chromatides, sauf au niveau du centromère.
Transition métaphase/anaphase --> activation de l’APC (Complexe Promoteur de l’Anaphase)
pour dissocier la cohésine et séparer les chromatides au niveau des centromères.
L’APC permet indirectement la migration des chromatides : ligase qui lie l’ubiquitine à la
sécurine qui était associée à la séparase.
Puis, la sécurine ubiquitinylée est éliminée par la voir du protéasome.
L’APC est sous le contrôle du gène CDC-20.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%