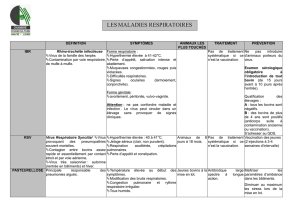
Virus Parainfluenzae

Virus Para-influenza
Nom
Famille, genre, espèce : Famille des Paramyxoviridae, sous famille des
Paramyxovirinae, genre Paramyxovirus, espèces PIV 1, 3, et genre
Rubulavirus, espèces PIV 2, 4 (même genre que le virus des oreillons).
Nom commun : néant
Mots clés
Para-influenza, infections respiratoires, rhinite, pharyngite.
Caractéristiques
Morphologie : Virus enveloppé, nucléocapside à symétrie hélicoïdale.
Antigènes majeurs et sérotypes :
o Spicules glycoprotéiques de l’enveloppe virale :
glycoprotéine HN à activité neuraminidasique et
hémagglutinante. Elle assure la fixation du virus aux cellules
cibles.
glycoprotéine F à activité hémolysante. Elle assure la fusion de
l’enveloppe avec la membrane cellulaire lors de la pénétration du
virus dans la cellule cible.
o Il existe des parentés antigéniques entre les différents types de PIV qui
s’étendent au virus ourlien.
o Les Ac sériques circulants après infection persistent longtemps mais
protègent mal contre une réinfection.
o Les IgA protègent efficacement les muqueuses mais sont fugaces.
Organisation du génome et génotypes :
o Génome à ARN de polarité négative avec transcriptase virale
(complexe des protéines P et L)
o Quatre génotypes PIV 1, 2, 3 et 4.
Lignées cellulaires permissives : culture difficile sur cellules LLC-MK2,
certaines souches sont isolables sur HeLa, Hep-2
o Particularités culturales identifiées : parfois volumineux syncytiums,
adsorption hématies cobaye.
o Effet cytopathogène : Formation de syncitiums : placards cellulaires
multinuclés résultant de la fusion des membranes cytoplasmiques de
plusieurs cellules sous l’action de la protéine F.
Cycle réplicatif intracellulaire : Réplication dans le cytoplasme de la cellule
infectée. Transcription préalable en ARN de polarité positive qui sert de brin
matrice pour la synthèse d’ARN génomique viral.
Modèles animaux : Non

Ecologie
Réservoir humain : PIV 1, 2, 3, et 4 sont strictement humains.
Réservoir animal : Virus de la maladie de Newcastle chez les oiseaux.
Survie à l’extérieur de l’hôte : Virus enveloppé, fragile à l’extérieur de l’hôte.
Pouvoir pathogène pour l’humain
Cycle infectieux
Porte d’entrée : Contamination par voie respiratoire, contacts inter humains
rapprochés.
Réplication primaire : Cellules cylindriques ciliées de l’arbre respiratoire
(fosses nasales, trachées, bronches)
Virémie primaire : Pas de virémie.
Réplication secondaire : Non
Virémie secondaire : Non
Organes cibles : Voies respiratoires supérieures et inférieures
Latence et/ou persistance et leurs mécanismes : Non
Transmission et période de contagion : Hiver, printemps.
Clinique
Période d’incubation : Incubation courte
Symptomatologie :
o Formes inapparentes dans la majorité des cas.
o Chez l’adulte : rhinites, pharyngites, trachéites bénignes.
o Chez le nourrisson ou le jeune enfant : symptomatologie identique mais
plus accentuée. Evolution rapidement favorable dans la majorité des
cas. Parfois, formes plus sévères avec bronchite ou pneumopathie
(observée avec le type PIV 3).
Complications : Non
Transmission verticale mère enfant : Non
Epidémiologie
Répartition des cas : mondiale, jeunes enfants en collectivité.
Hôtes et zoonoses : PIV 1, 2, 3, et 4 sont strictement humains.
Déclaration obligatoire : Non
Traitement anti-viral
Cibles des anti-viraux : Pas de traitement anti-viral efficace.
Mécanisme de résistance : Non
Antiseptiques et désinfectants : Non

Diagnostic
Signes biologiques non spécifiques
Hémogramme en général normal.
Diagnostic direct
Nature des prélèvements :
o On récupère les cellules cylindriques ciliées de l’arbre respiratoire à
partir de :
secrétions nasales par écouvillonnage ou extracteur à mucus.
secrétions trachéobronchiques.
secrétions bronchiques par kinésithérapie respiratoire chez les
nourissons.
exsudat auriculaire si otite.
o Transport immédiat au laboratoire ou transport dans un milieu
protecteur si délai (+2 à +6°)
Immuno-détection et microscopie :
o Détection des Ag viraux par immunofluorescence à l’aide d’Ac
spécifiques commercialisés de façon isolée ou en association avec des
Ac spécifiques d’autres virus respiratoires.
Méthode rapide.
C’est la méthode de choix pour le diagnostique d’une infection
active à PIV.
Culture virale :
o Difficile sur cellules diploïdes humaines MRC5.
o Réservée à la recherche.
Biologie moléculaire : L’amplification génique par RT-PCR a été décrite pour
la détection directe du virus mais son utilisation reste limitée. L’utilisation à
grande échelle de ces techniques est en cours d’évaluation.
Diagnostic indirect, sérologie
Recherche des Ac spécifiques des PIV par fixation du complément.
La mise en évidence d’une séroconversion ou d’un titre élevé en Ac
spécifiques permet le diagnostic d’infection à PIV en l’absence de prélèvement
respiratoire.
Ce test est utilisable chez les enfants de plus de cinq ans (manque de
sensibilité du test avant 5 ans).
Méthodes de mise en évidence des résistances
Néant
Bases de la thérapeutique

De l’infection déclarée :
o Traitement symptomatique.
o Pas de chiomiothérapie efficace.
De la prophylaxie : Pas de prophylaxie spécifique aux infections à PIV.
Risque professionnel
Origine : néant
Classe de risque : classe 2
Bibliographie
http://www.chu-rouen.fr/ssf/organ/metapneumovirus.html
Notes
Rédacteurs et validation
Rédacteurs : Virginie Falcot
Validation : Pr Patrice André
1
/
4
100%