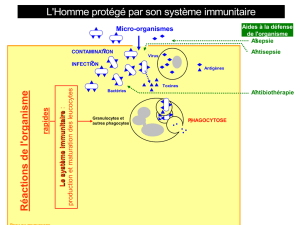
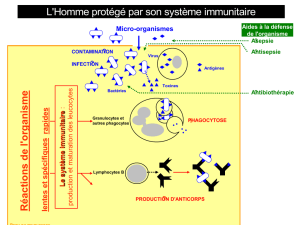
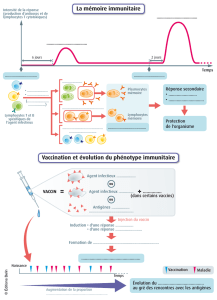
immunite anti-tumorale

Immunologie– Immunité anti-tumorale – page 1/7
Julie’n’Caro
29/04/09 (…)
IMMUNOLOGIE
14h-15h
M’n’M
Séverine Boullier
IMMUNITE ANTI-TUMORALE
Nous verrons aujourd’hui les mécanismes de défenses contre les tumeurs chez l’adulte ainsi
que les techniques d’immunothérapie anti-cancéreuse. Puis si on a le temps (réjouissez-vous
d’avance, nous l’aurons!) les mécanismes de rejet des greffes.
Ce chapitre pose beaucoup de questions, avec souvent peu de réponses sur la façon dont le
système immunitaire gère réellement ces troubles.
Dans la réponse anti-tumorale, ce qui nous intéresse en premier est :
- la nature de l’agent responsable de la transformation d’une cellule saine en cellule
tumorale. On ne parlera pas des tumeurs dues au virus, car la réponse est ici « clairement » une
réponse anti-virale.
Les causes sont multiples : agents chimiques, mutations spontanées… Mais en tout cas ce qui
caractérise une cellule cancéreuse c’est qu’elle a perdu sa capacité à réguler sa prolifération.
I- Les caractéristiques antigéniques des cellules tumorales
1. Définition
Une cellule tumorale est une cellule du soi. Or, le système immunitaire sait faire la différence entre
le soi et le non-soi donc a priori il ne devrait pas voir ces cellules. En pratique, il existe bien une
réponse. Heureusement car des cellules cancéreuses sont générées tout au long de la vie et la
réponse immunitaire est là pour les gérer. Lorsque le système immunitaire est dépassé (cellules en
grandes quantités et/ou très malignes…) , on a formation de tumeur.
2. Quelles modifications antigéniques ?
Il peut y avoir perte ou « gain » d’antigènes.

Immunologie– Immunité anti-tumorale – page 2/7
Ainsi, les cellules tumorales peuvent perdre une partie des antigènes (AG) normalement exprimés
par la cellule saine mais cela n’a normalement aucun impact sur la réponse immunitaire. Par
exemple on peut avoir perte des AG de groupe sanguin.
De plus, généralement elles se dédifférencient. On a donc perte des AG de différenciation, mais
ceci est difficile à voir.
Le plus marquant est la perte de molécules du CMH de type I car cette perte est très souvent
associée à l’augmentation du processus cancéreux.
En parallèle, elles expriment de nouveaux antigènes, potentiellement repérables par le système
immunitaire et permettant une réponse.
Rq : ex. lorsque la tumeur à une origine virale, les antigènes en question sont essentiellement des
antigènes viraux qui vont donc provoquer une réponse de type anti-virale, donc mieux connue que
ce dont nous allons parler par la suite.
- une partie des antigènes de la cellule saine d’origine peuvent être surexprimés. On
pensait à l’origine que comme ce sont des molécules du soi, elles ne sont pas vues. Mais
en réalité ce seraient de bons candidats : il existerait un niveau basal en dessous duquel
le système immunitaire ne réagit pas. Mais si on multiplie par 100 ou 1000 le nombre de
ces molécules, alors l’excès entraîne une réponse.
- il y a également apparition de nouveaux antigènes sur la cellule : antigènes fœtaux (qui
ne sont donc plus du soi, mais du non-soi) et des antigènes spécifiques de la tumeur
associée à des mutations génétiques qui provoquent une modification protéique
synthèse de protéine de tumeur, donc du non-soi.
On s’intéresse à ces AG de cellule tumorale car ils pourraient être de bonnes cibles thérapeutiques.
Question : Est-ce que toutes les cellules tumorales perdent certains antigènes et en acquièrent
d’autres ?
Non, toutes les combinaisons sont possibles selon l’agressivité de la tumeur. Il est bien évident que
plus une tumeur est agressive, plus elle exprimera des modifications antigéniques.
3. Identification des AG tumoraux
Ce sont donc potentiellement des cibles d’immunothérapie. Ils sont de deux grands types :
- AG définis par la présence d’anticorps (AC) dans le sérum, ce qui implique donc qu’ils
ne sont pas intracellulaires mais présents à la surface de la cellule ou bien excrétés ou
sécrétés par celle-ci. Certains ne sont pas utilisables pour la thérapie mais seulement
pour le diagnostic ou le pronostic et suivi de traitement. Par exemple, les marqueurs PSA
sont des antigènes caractéristiques du cancer de la prostate : une augmentation des PSA
traduit une réactivation de la tumeur. D’autres peuvent être utilisés dans le cadre d’une
thérapie monoclonalemais uniquement s’ils sont exprimés en surface et si non toxiques
pour les autres cellules. Ils sont à l’origine de traitements se terminant par « -mab » pour
« monoclonal anti-body ». Ex. le Rituximab.
- AG exprimés dans la cellule tumorale mais incapable d’induire une réponse humorale
car ils ne sont pas libérés dans le milieu extérieur ce sont des AG T-dépendants. Ce
sont ceux que l’on essaie d’identifier. Ils sont très intéressants car créent une réponse à
médiation cellulaire. Les antigènes ou les peptides dérivés d’antigènes sont présentés via
le CMH. Or le CMH ayant une grande variabilité d’une personne à l’autre, la nature des
antigènes ou peptides dérivés présentés est très grande. La réponse dépendra donc de la
nature de l’AG présenté qui varie selon les patients. La grande variabilité les rend très
difficile à identifier.
Ex. du mélanome : il a été très étudié pour la mise en place d’une immunothérapie –avec
de bons résultats d’ailleurs-. Tous les premiers essais avaient été infructueux in vitro car
on n’avait pas les bons peptides avec les bons allèles du CMH.

Immunologie– Immunité anti-tumorale – page 3/7
II- Mise en place de la réponse anti-tumorale
1. Principe On sait qu’à un moment, la cellule
tumorale est reconnue par le CMH.
Comment ? On ne sait pas trop finalement.
Ce que l’on sait : les cellules dendritiques,
vont, à un moment donné, avoir accès à
ces antigènes. Il faut que le système
immunitaire ait reçu un signal de danger =
AG associé à un problème. Le signal de
danger le plus classique est la réponse
inflammatoire. En effet, elle est quasi-
systématiquement associée à l’arrivée d’un
pathogène et l’activation de TLR. Ce TLR
est un marqueur spécifique des ligands exprimés par les microorganismes et n’est en aucun cas
exprimé par la tumeur, qui elle est baignée dans un environnement anti-inflammatoire. Il manque
donc un maillon pour que la CPA (ici, cellule dendritique) reçoive le signal de danger et déclenche
une réponse. On a donc plutôt en général des cellules dendritiques inhibitrices.
Mais si elle parvient à éviter ces pièges, elle va reconnaître et pourvoir activer (via présentation
d’AG) les effecteurs de la réponse = la phagocytose.
La cellule tumorale est alors phagocytée. Les antigènes sont présentés via le CMH-II, ce qui active
les LT CD4. Problème : on veut activer les LT-CD8 nécessaires à une réponse de type Th 1 ?
Pour déclencher une réponse de type Th1, il faut que les peptides antigéniques se trouvent dans le
cytoplasme de la CPA et soit présentés via le CMH-I. Or, il n’y a, a priori, pas de raisons que l’AG
se retrouve dans le cytoplasme.
Dans certains cas, les cellules dendritiques peuvent faire une « cross-présentation » = une partie des
AG phagocytés sont déviés et présentés par le CMH I aux lymphocytes qui sont alors capables de
mettre en place une réponse de type Th1 (cytotoxique).
Une réponse spécifique : Th1 est mise en place, avec une quantité importante de cellules
cytotoxiques, une grande quantité d’interféron (IFN), mais surtout activation des macrophages.
L’objectif : détruire les cellules tumorales !!! C’est le SEUL objectif du système immunitaire.
2. La réponse immunitaire Le premier effecteur sont les LT
cytotoxiques. Or plus la cellule devient
agressive, plus elle perd ses molécules du
CHM I et même si la réponse
immunitaire était la bonne auparavant,
elle ne sert plus à rien ensuite.
Donc pour éliminer quand même ces
cellules, le système immunitaire fait
appel aux AC. Encore faut-il que la
réponse humorale ait pu être mise en
place et que l’AG correspondant soit
toujours présent en surface.
Les AC ne font rien concrètement sur les cellules tumorales mais permettent deux choses :
- activation des lymphocytes NK (natural killer) qui sont en fait des cellules cytotoxiques
dépendant des AC

Immunologie– Immunité anti-tumorale – page 4/7
- l’opsonisation et donc l’efficacité des macrophages (qui est multipliée par 10 ou 100 en présence
d’ IFN).
Il va donc s’agir d’une destruction dépendante des AC.
En plus d’être cytotoxique, une cellule NK
« scanne » la surface des autres cellules : si
elles expriment en surface des récepteurs
du CMH I, cela envoie un signal OFF la
cellule NK trace sa route ; par contre si une
cellule perd le CMH, le signal OFF n’est
plus envoyé NK redevient cytotoxique.
Mais les cellules NK peuvent également
permettre la destruction d’une cellule
comportant encore des molécules du CMH.
En effet si cette cellule est entourée d’AC,
la cellule NK qui contient en surface des
récepteurs FcR, fixe le complexe immun ce
qui déclenche un signal ON plus fort que le
signal OFF (celui du à la présence de molécules du CMH, on le rappelle), ce qui active sa fonction
cytotoxique.
Au fur et à mesure que les cellules cancéreuses se développent, on s’est rendu compte que la qualité
de la réponse immunitaire diminuait. Il y a parallèlement à ce phénomène, apparition d’une
nouvelle population de cellules : des LT régulateurs avec une phénotype particulier : ce sont des LT
CD4+ CD25+ . On ne sait pas quels antigènes ils reconnaissent, on connaît juste leur fonction : ils
diminuent la réponse immunitaire en produisant une quantité impressionnante d’IL10 et TGF dont
l’association agit sur tous les effecteurs de la réponse à médiation cellulaire.
Ces médiateurs bloquent le développement de la réponse Th1, en stoppant l’activité des LT
cytotoxiques, des cellules NK, des macrophages et empêche la production d’IFN par les
lymphocytes.
Les cellules Treg sont également utilisées comme marqueurs pronostic d’évolution de cancer. En
particulier dans le cas de cancer du sein : plus il y en a, plus le pronostic est sombre.
III- Mécanismes d’échappement des cellules tumorales
Les premières cellules tumorales sont les moins armées pour résister au système immunitaire, ce
sont donc les plus vite éliminées. Les autres vont échapper à la réponse immunitaire, et plus elles se
développent, plus elles y échappent.
1. Résistance des cellules tumorales aux effecteurs immunitaires
Les cellules deviennent capables d’échapper aux effecteurs immunitaires : c’est ce que l’on appelle
l’évasion immunitaire (elles deviennent invisibles). Plusieurs mécanismes entrent en jeu.
Tout d’abord il y a modification des capacités de homing du tissu. En effet pour que les effecteurs
immunitaires puissent entrer dans le tissu, il faut les bonnes molécules (adhésines, intégrines…) qui
permettent cette entrée. Il y a également blocage de la production du gradient de chémokines qui
permet de guider les cellules immunitaires jusqu’à la tumeur.
Il y a aussi altération de l’antigénicité des cellules tumorales. Cette variabilité rend donc la capacité
de ces cellules à être reconnues très variable. Ceci vient de l’instabilité génétique liée à l’absence de
système de correction des erreurs. Le système immunitaire favorise la sélection des cellules
cancéreuses les plus résistantes. Les effecteurs arrivent au contact des cellules qui se multiplient
anarchiquement. Celles possédant l’antigène initial sont éliminées. Mais des mutation anarchiques

Immunologie– Immunité anti-tumorale – page 5/7
atteignent parfois ces antigènes, qui changent et donc ne sont plus reconnus. Elles se multiplient
donc, de plus en plus vite, etc… C’est la sculpture du répertoire tumoral.
Cette modification de l’antigénicité se traduit également par une perte du CMH de classe I.
Enfin les cellules tumorales acquièrent des propriétés de résistance à l’apoptose, devenant ainsi
immortelles. Or le mode d’action des cellules cytotoxiques et NK est d’induire l’apoptose. La
cellule ciblée reçoit le signal de mort et entre alors en apoptose. Les cellules tumorales acquièrent la
résistance de deux façons :
- les molécules à activité anti-apoptotique sont activées
- celles à activité apoptotique sont inhibées.
La résistance aux effecteurs immunitaires passe également par une phase de « contre-attaque » des
cellules tumorales. Les cellules activées expriment des récepteurs Fas-L qui induisent la mort des
effecteurs cytotoxiques. Elles mettent également en place des leurres immunologiques anti-
apoptotiques qui perturbent les cellules effectrices qui arrivent sur le lieu de la tumeur.
2. Inhibition de l’induction d’une réponse immunitaire spécifique
Très vite et très tôt, les cellules tumorales peuvent limiter la mise en place de la réponse
immunitaire grâce à leur faible immunogénicité qui dépend de la nature de l’antigène. En effet, pour
que la réponse se mette en place, il faut que les antigènes arrivent jusqu’aux nœuds lymphatiques.
Soit il est excrété ou sécrété, ou bien il meurt et, dans tous les cas, est drainé jusqu’aux nœuds. De
plus, très souvent, il n’y a aucun signal de danger associé.
Même si le système immunitaire a accès à l’antigène, on peut voir apparaître une certaine tolérance
induite par les cellules cancéreuses. Celle-ci passe par la mise en place de lymphocytes Treg, par le
fait que le stroma entourant la cellule cancéreuse est baigné dans un environnement contenant des
concentrations importantes de molécules immunorégulatrices. Il y a modification de la maturation
des cellules dendritiques, qui deviennent donc « tolérisantes » et ainsi n’activent plus les LT. Les
signaux donnés sont donc des signaux d’anergie, qui inhibent les lymphocytes. Il est par la suite
extrêmement difficile de revenir en arrière en ce qui concerne la programmation d’un lymphocyte.
Donc même avec une immunothérapie il est très difficile de « dés-anergiser » les LT.
Comment la cellule dendritique peut-elle devenir inhibitrice ? Par des modifications de voies
métaboliques indispensables au fonctionnement correct du système immunitaire : les métabolismes
du tryptophane et de l’arginine.
Le tryptophane est un acide aminé essentiel, très minoritaire totalement indispensable à la
prolifération des LT ainsi que de très nombreux micro-organismes. Le mécanisme de blocage du
tryptophane est donc un moyen physiologique de se débarrasser des pathogènes. Le processus
tumoral va détourner ceci grâce à une enzyme : l’IDO. La cellule dendritique inhibitrice (iDC)
produit l’IDO qui dégrade le tryptophane et empêche donc la prolifération des LT.
Une des voies de fonctionnement serait donc la privation en tryptophane.
De même pour l’arginine (aa nécessaire pour l’activation des LT), l’iDC va empêcher l’accès de
l’arginine aux LT ? empêchant l’activation et la différenciation des LT.
Bilan : il faut bien comprendre que la cellule au départ possède un à deux mécanismes
d’échappement.
 6
6
 7
7
1
/
7
100%