Traduction des gènes

1
Traduction des gènes
Phénomène complexe qui a lieux pour les eucaryotes dans le cytoplasme, cette traduction est
réalisé dans le ribosome, elle met en jeu une centaine de macromolécule, ARNm, ARNt, les
ribosomes, les protéines et parmi ces protéines des enzymes.
Permet le transfert de l’information génétique contenu dans l’ADN, transcrit comme ARN
transféré à une succession d’acides aminés grâce au code génétique, il est universellement
utilisé dans le monde du vivant. Les acides aminés doivent être activé sous forme d’amino
acides ARNt pour être incorporé à la protéine.
La réaction de biosynthèse de la protéine à lieu en 3 étapes :
Initiation
Elongation
Terminaison
Modification post traductionnelle non envisagé ici.
Les ribosomes sont de véritables usines de fabrication des protéines, ils comportent une
grande sous unité et une petite sous unité. Cette synthèse protéique est la cible principale des
antibiotiques. Il a été mis en évidence récemment que cette réaction peut être bloqué grâce
aux micro ARN.
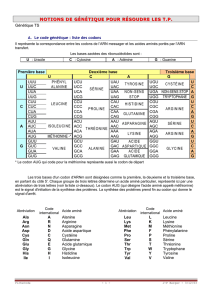
Code génétique : Expérience Chapville et Lipman
L’information portée par l’ARNm est reconnu par ARNt et non par l’acide aminé. Dans cette
expérience on utilise un acide aminé radioactif, la cystéine marqué au 14C, elle va être réduite
chimiquement, on se retrouve avec un complexe chimique, la cystéine va être alors transformé
en alanine radioactive. On a la formation d’un hybride radioactif avec l’ARNt de la cystéine.
Incorporation de l’acide aminé dans la protéine, on utilise pour cela un système acellulaire de
réticulocytes, qui sont les précurseurs des globules rouges, les GR n’ont pas de noyaux mais
leurs précurseurs si.
Le matériel va être synthétisé in vitro, le peptide qui devait contenir la cystéine contient
l’alanine radioactive. Il reconnaît donc au niveau de l’ARNm l’ARNt et non l’acide aminé.
ARNt joue le rôle d’adaptateur de l’acide aminé.
La reconnaissance se fait par un système qui implique 3 paires de bases, système qui se fait
entre ARNm et ARNt sur 3 paires de bases. On parle de codons sur l’ARNm et d’anti-codons
sur l’ARNt ; cette reconnaissance se fait par complémentarité des bases.
Le code génétique est universel, il est utilisé par tous les organismes vivant à peu d’exception
comme les mitochondries. Il est non chevauchant 4^3 =64 triplets possibles (4 bases faites de
3 aa) 61 codons codants pour les 20 AA naturels et 3 qui spécifient pour aucun AA, ce sont
les codons stop.
Il est aussi dégénéré, plusieurs codons spécifient pour un même acide aminé, mais il n’est
jamais AMBIGÜE ! En effet un codon ne spécifie jamais pour deux acides aminés différents.
La dégénérescence n’est pas du au hasard, ce sont les acides aminés ayant un nombre élevé de
codons.
Les codons qui spécifient pour un même acide aminé sont dits synonymes.
Seulement méthionine et tryptophane qui sont codés par un seul codon. En général les codons
synonymes de différent que par la 3e base du codon.

2
L’inosine est inhabituel, c’est un nucléoside sur les ARNt, présent dans certains anti codons, il
permet de connaitre 3 bases différentes, il introduit une certaine flexibilité.
1°) première règle porte sur les 2 premières bases du codon qui s’apparient de façon
classique, la reconnaissance et précise et les codons différents par leurs 2 premières bases
doivent être reconnus par des ARNt différents.
2°) La troisième base du codon = 1e base de l’anti codon. C’est cette première base qui
détermine si on reconnaît un seul codon, deux ou trois codons. En effet si cette première base
est une inosine, on peut reconnaître 3 codons différents.
Le cadre de lecture : C’est ce qui permet de synthétiser la protéine, la séquence de l’ARNm, il
est dit ouvert s’il s’agit d’un enchaînement de triplet ne renfermant pas de codons STOP et
ceci à partir d’un codon de départ.
Pour la traduction, il faut l’activer via une enzyme qui est l’aminacylARNt synthétase une fois
activé il peut rentrer et on retrouve les 3 phases :
Initiation
Elongation
Terminaison
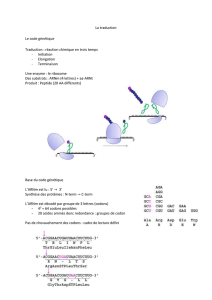
Initiation :
Activation des Acides amines et fixation sur ARNt réalisé par des AminoAcyl ARNt
synthétase spécifiques pour chacun des acides aminés, chaque une est capable de fixer un
acide aminé. Réaction en 2 étapes :
1- Formation d’une aminoacyladénilate grâce à l’énergie apporté par l’ATP, l’ATP
est sous forme d’AMP avec libération de diphosphate.
2- Transfert d’un groupement aminoacyl sur l’ARNt avec libération de l’AMP
Le bilan énergétique définitif est la consommation de 2 liaisons riches en énergies.
Spécificité : des aminoacides ARNt synthétase.
Il existe au moins une ARNt synthétase pour chacun des acides aminés donc au moins
20 enzymes différents. Les synthétases assurent la spécificité de la biosynthèse protéique en
reconnaissant le bon Acide Aminé et le bon ARNt par une double spécificité.
On dit que l’enzyme a deux substrats. C’est au niveau du site 1 que l’enzyme reconnaît l’acide
aminé, via sa charge et sa taille. On dit qu’il s’agit d’un double tamisage.
Double spécificité =/= de double tamisage.
Pour les eucaryote : besoin de 5 éléments
1- Acide aminé initiateur. Chez les eucaryotes c’est la méthionine. ARNt spécifique
ARNt initiation, fixe la méthionine. Méthionine initiatrice sera coupé après la
synthèse protéique.
2- Ribosome avec deux sous unités (60S et 40S)
3- L’ARNm
4- Le Facteur protéique permettant l’initiation de EIF (eucaryote initiating factor)
énergie sous forme d’ATP.

3
Le complexe méthionine facteur d’initiation consomme deux liaisons riches en énergie.
Dissociation du ribosome, structure qui est 80S, formation d’un complexe EIF 2 – GTP avec
la méthionine activé. C’est l’étape préliminaire
1°) Formation du complexe petite unité ribosomale avec la méthionine
2°) Formation du complexe définitif et déplacement de la petite sous unité jusqu’au
codon AUG qui code pour la méthionine.
3°) Formation du complexe d’initiation définitif et arrivée de la grande sous unité
ribosomale au niveau de l’AFG (codon start) sur un ribosome deux site de fixation : P et A.
Durant cette phase, il y a consommation de GTP et libération de facteur protéique
Chez les procaryotes :
Ressemblance mais avec des différences.
Initiation avec la méthionine mais avec la formyl.
1- Activation de la méthionine
2- Formylation de la méthionine avec la transformylase
Spécifique des procaryote : Existance d’une séquence en amont de l’AUG qui est riche en
purine séquence de Child endgardon qui permet de fixer via ARNr 16S la petite sous unité
ribosomale (région 5’).
Elongation d’un gène protéique
On a besoin de 3 facteurs principaux qui sont l’Amino Acide ARNt, le GTP qui
apporte de l’énergie et enfin les facteurs protéique d’élongation.
1- Fixation : de l’amino acide ARNt, on a besoin de EF1 alpha qui est capital dans la
fixation. On a aussi besoin d’énergie sous forme de GTP (consommation d’une
liaison riche en énergie).
2- Peptidisation réalisé par la peptidyl transferase. C’est une enzyme de la grande
sous unité ribosomale. L’ARNt va être déacylé, C’est une étape qui ne consomme
pas d’énergie.
3- Etape de translocation : premièrement ARNt qui a été déacylé qui quitte le site P,
deuxièmement le peptide ARNt passe du site A au site B, l’ARNm se déplace sur
le codon. Ce mécanisme de déplacement de l’ARNm qui bouge d’un codon est
effectué par un enzyme qui est la translocase encore appelé facteur
Ce changement de site : dans la distérine, toxine bactérienne qui peut etre mortelle car elle
inhibe la synthèse au niveau de la translocase.
Bilan énergétique : au cours de l’élongation le bilan énergétique est de 4 liaisons riches en
énergie. En effet 2 pour activation de l’AA, 1 pour fixation sur le site 1. Un pour le
déplacement.
Terminaison :
Arrivé au 3 codons STOP,on va avoir libération de la protéine avec un changement
d’activité de la peptidide transférase qui prend une activité d’hydrolase.
1
/
3
100%