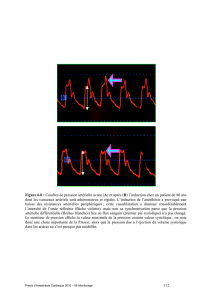
Anesthésie et choc hémorragique chez l'adulte

Anesthésie du patient adulte
en état de choc hémorragique
A. Edouard 1, D. Edouard 2
1 Service d'anesthésie-réanimation, centre hospitalier de Bicêtre, 94275 Le Kremlin-Bicêtre,
2 Service d'anesthésie-réanimation, hôpital Antoine-Béclère, 92141 Clamart, France
POINTS ESSENTIELS
· L'efficacité des mécanismes de compensation d'une hypovolémie nécessite l'intégrité du
système sympathique. Les hémorragies massives et brutales provoquent une sympatho-
inhibition.
· L'hypoxémie aiguë et chronique entrave le contrôle neurohumoral de la fonction
cardiovasculaire.
· Le décubitus latéral gauche partiel chez la femme enceinte est la seule modification
posturale utile au cours du choc hémorragique.
· Malgré le retentissement cardiovasculaire de tous les médicaments, une séquence rapide
d'induction (hypnotique-suxaméthonium) est souhaitable chez le patient non encore intubé.
· En l'absence de lésion encéphalique ou sous réserve d'un monitorage neurologique adéquat,
la base de l'entretien de l'anesthésie est un anesthésique volatil (isoflurane sans protoxyde
d'azote) associé à la curarisation.
· L'expansion volémique est la base du traitement médical. La perfusion d'un vasopresseur est
utile pour renforcer le tonus adrénergique, limiter le volume de solutés perfusé et combattre
une éventuelle vasoplégie inflammatoire précoce.
· L'anémie aiguë avec hypovolémie entrave l'oxygénation tissulaire et provoque une
thrombopathie. Une coagulopathie de consommation est la principale cause de thrombopénie.
Une fibrinolyse exagérée est plus importante qu'un déficit en cofacteurs dans un saignement
anormal.
· Le choc hémorragique et son traitement modifient la pharmacocinétique des médicaments,
en particulier ceux de l'anesthésie et les antibiotiques.
· L'association hypothermie-acidose-coagulopathie et/ou l'apparition de bradycardie
témoignent d'une atteinte des ultimes réserves du patient et imposent une conclusion
provisoire de l'intervention.
Une intervention chirurgicale, radiologique ou endoscopique d'hémostase chez un patient en
état de choc hémorragique nécessite le plus souvent la pratique d'une anesthésie. Les
situations les plus fréquemment rencontrées sont les traumatismes graves, les hémorragies
abdominales par saignement digestif, intrapéritonéal ou rétropéritonéal et les complications
hémorragiques de la grossesse. Si l'anesthésie locorégionale est concevable dans cette

dernière circonstance lorsqu'elle a été induite avant l'apparition de l'état de choc, l'anesthésie
générale sera le plus souvent adoptée face à une hypovolémie sévère. Il importe d'en définir
les modalités simples pour permettre à l'anesthésiste de se consacrer à la réanimation
périopératoire, afin de réduire la morbimortalité des patients. La connaissance des
mécanismes d'homéostasie cardiovasculaire en fonction du patient est un préalable à la qualité
de la prise en charge.
RAPPEL PHYSIOPATHOLOGIQUE
Sujet sain
Le contrôle neurohumoral, à court terme, de la pression artérielle tend à assurer la stabilité du
volume télédiastolique des cavités ventriculaires et à redistribuer le débit d'éjection du
ventricule gauche vers des territoires vasculaires à haut niveau métabolique, tels le cœur et le
cerveau [1]. Au cours de la survenue d'une hémorragie, les volumes sanguins de réserve,
essentiellement mésentériques sont mobilisés vers le compartiment vasculaire central pour
maintenir le remplissage ventriculaire malgré le raccourcissement de la diastole lié à la
tachycardie réflexe [2] [3]. Cette mobilisation résulte de la veinoconstriction active et
passive ; cette dernière provient de l'élasticité des veines dont la réduction de capacité est
facilitée par une moindre distension en raison du faible flux secondaire à la vasoconstriction
artériolaire d'amont. Cette vasoconstriction précapillaire contribue au maintien de la pression
artérielle. Elle concerne d'abord les circulations musculocutanée et hépatosplanchnique
expliquant l'ampleur de l'élévation de la lactatémie au cours du choc hypovolémique et la
valeur pronostique de sa normalisation rapide. La vasoconstriction respecte longtemps les
circulations cérébrale et coronaire. Ainsi, en l'absence de pathologie encéphalique aiguë, une
hypotension artérielle sévère et prolongée ne s'accompagne pas d'anomalies histologiques ou
fonctionnelles cérébrales [4]. En revanche, au niveau myocardique, des lésions endocardiques
d'hypercontraction sont décrites ; elles concourent à une dysfonction diastolique ventriculaire
et se traduisent par une mise en circulation de troponine cardiospécifique [5] [6] [7]. La
vasoconstriction veineuse et artérielle est noradrénergique par la libération du tonus
sympathique vasculaire secondaire à une levée de l'inhibition tonique du baroréflexe carotido-
aortique activé par la pression artérielle et du baroréflexe cardiopulmonaire activé par le
volume des cavités cardiaques. En l'absence de déplétion sodée, l'angiotensine II et la
vasopressine ont un rôle limité. Au niveau du réseau capillaire, la réduction de pression
hydrostatique intravasculaire provoque un mouvement liquidien vers le vaisseau à partir de
l'interstitium et des lymphatiques, restaurant partiellement le volume plasmatique circulant
(jusqu'à la moitié d'une perte limitée à 20 % du volume sanguin), créant l'hémodilution et
maintenant la protidémie. Cette réduction de volume interstitiel facilite l'oxygénation
cellulaire en raccourcissant la distance de diffusion de l'oxygène à partir des vaisseaux.
L'endothélium vasculaire, par la production de monoxyde d'azote, module la vasoconstriction
adrénergique et atténue la demande métabolique cellulaire.
Lorsque l'hémorragie est massive ( 30 % du volume sanguin circulant) et brutale, une
sympatho-inhibition succède à la stimulation adrénergique. Cette inhibition est le fait d'une
tension extrême des barorécepteurs ventriculaires liée à un résidu télésystolique virtuel et/ou
la conséquence d'une activation paradoxale des barorécepteurs artériels liée à une
vasoconstriction périphérique intense [8]. Malgré une libération massive d'adrénaline
médullosurrénalienne, d'angiotensine II et de vasopressine, bradycardie et vasoplégie
conduisent au collapsus cardiovasculaire [9].

Grossesse normale
Au cours de la grossesse normale, un débit cardiaque élevé est nécessaire à la perfusion
nourricière de l'unité utéro-placento-fœtale [10]. Cela est obtenu par la conjonction d'une
tachycardie de repos et d'une augmentation du volume plasmatique liée à une stimulation du
système rénine-angiotensine-aldostérone d'origine œstrogénique, créant une anémie de
dilution. Une vasodilatation artérielle périphérique facilite l'éjection ventriculaire et se traduit
par une pression artérielle plus basse que celle mesurée en dehors de la grossesse. La
réduction du tonus vasculaire et l'atténuation de l'effet des substances vasoconstrictrices sont
liées à une production accrue de monoxyde d'azote grâce à une stimulation de la NO-synthase
endothéliale et de l'induction d'une NO-synthase, en particulier dans l'unité
utéroplacentaire [11]. Malgré l'entrave à la circulation veineuse par l'utérus gravide, le retour
sanguin vers le cœur est maintenu par une augmentation du tonus veineux des membres
inférieurs. L'adéquation des mécanismes compensatoires de l'hypovolémie est attestée par
l'absence d'hypotension orthostatique au cours de la grossesse normale. Leur sollicitation
permanente réduit toutefois la réserve cardiovasculaire de la femme enceinte face à une
hémorragie. Certaines caractéristiques respiratoires de la femme enceinte facilitent le
développement de l'hypoxémie maternelle et contribuent à l'hypoxie fœtale : une réduction de
la capacité résiduelle fonctionnelle contrastant avec une demande périphérique élevée en
oxygène, un déplacement céphalique du diaphragme, un cardia incompétent et une vidange
gastrique incomplète facilitent les régurgitations de liquide digestif [12]. Une augmentation de
l'activité fibrinolytique au cours de l'accouchement accélère l'apparition des coagulopathies au
cours des hémorragies péri-partum [13].
Interférences pathologiques et pharmacologiques
Dans certaines circonstances, l'efficacité du contrôle neurohumoral de la pression artérielle est
réduite ou la transition vers la phase sympatho-inhibitrice est favorisée : le vieillissement, la
toxémie gravidique, une pathologie sous-jacente (cardiopathie, cirrhose, dysautonomie
neurovégétative), un médicament (alpha ou bêta bloquant, inhibiteur de l'enzyme de
conversion, antagoniste des récepteurs à l'angiotensine II, inhibiteur calcique), une
intoxication (par exemple, l'alcoolisme aigu ou chronique) [14] [15]. Le contrôle réflexe de la
fonction cardiovasculaire est altéré chez les patients avec une pathologie pulmonaire
chronique hypoxémiante [16]. L'hypoxémie aiguë facilite l'apparition d'une syncope
vasovagale au cours de l'hypovolémie modérée au travers d'une moindre libération de
noradrénaline, par les terminaisons nerveuses sympathiques [17] et/ou d'une vasodilatation
liée à l'adaptation métabolique régionale [18]. L'oxygénothérapie active le baroréflexe artériel
et ralentit le cœur [19] [20].
Les médicaments de l'anesthésie, en particulier les hypnotiques, interfèrent avec les
mécanismes compensatoires de l'hypovolémie. Chez le sujet normovolémique, un nouvel état
d'équilibre s'établit sous anesthésie générale, grâce à une adaptation cardiovasculaire à la
réduction de la demande tissulaire. En cas d'hypovolémie, les médicaments de l'anesthésie
rendent la pression artérielle directement dépendante de la perte volumique, en raison de leurs
effets cardiodépresseurs et vasodilatateurs ainsi que de leur action sur chaque composante des
arcs réflexes (mécanorécepteurs, centres vasomoteurs, transmission ganglionnaire et neuro-
effectrice des fibres sympathiques efférentes) [21]. Les caractéristiques de la technique
d'anesthésie idéale chez le patient hypovolémique seront une simplicité d'application, une
stabilité de l'effet pendant l'intervention d'hémostase, une facilitation de l'assistance

ventilatoire, une interférence minimale avec les mécanismes homéostatiques et une absence
d'interaction médicamenteuse avec les médicaments sympathomimétiques.
PÉRIODE OPÉRATOIRE
L'abord des voies aériennes et la nécessité d'une anesthésie de qualité, pour éviter la
réminiscence de l'acte opératoire par le patient, sont des caractéristiques importantes de
l'anesthésie du sujet en état de choc hémorragique [22] [23]. Décrire séparément l'anesthésie
et la réanimation de la prise en charge est utile pour l'exposé, mais ces deux activités doivent
être menées simultanément dans la réalité.
Mesures générales
Ambiance
L'intervention d'hémostase doit suivre immédiatement l'induction de l'anesthésie. Celle-ci est
réalisée en salle d'opération ou, à défaut, le transfert dans cette salle doit nécessiter le
minimum de manipulation. L'accueil du patient en état de choc hémorragique peut, par
exemple, se faire directement sur la palette de la table d'opération. Une température ambiante
supérieure ou égale à 24 °C est recommandée pendant la prise en charge ; les matelas à eau
chauffants sont contre-indiqués chez les patients en état de choc en raison de la possibilité de
brûlures au niveau des tissus hypoxiques comprimés. L'équipe chirurgicale doit être prête à
intervenir au cours de l'induction anesthésique pour contribuer à la réanimation (massage
cardiaque, clampage aortique, assistance circulatoire, trachéotomie) en cas de décompensation
cardiorespiratoire du patient. C'est pourquoi la mise en place des champs précède parfois
l'induction anesthésique. La répartition des tâches au sein de l'équipe médicochirurgicale doit
permettre à l'anesthésiste de disposer de deux personnes pour l'aider.
Position
Des modifications de posture (position déclive tête basse ou surélévation des membres
inférieurs) sont souvent pratiquées chez le patient en état de choc hémorragique. Le volume
de sang mobilisé vers le compartiment central est faible : 150 mL chez le sujet
normovolémique [24]. Ce transfert sanguin limité augmente l'éjection du ventricule gauche
sain [25]. En cas de dysfonction diastolique du ventricule gauche, son éjection est inchangée,
tandis qu'une dilatation du ventricule droit s'accompagne d'une réduction de sa fraction
d'éjection [26]. Au cours du sepsis, la position de Trendelenburg améliore de façon
inconstante l'état hémodynamique en raison d'un probable stockage de sang dans le
compartiment vasculaire mésentérique [27] [28]. Chez des patients hypovolémiques, la
position déclive [24], comme l'application d'un pantalon antichoc [29] [30], élève la pression
artérielle par une vasoconstriction périphérique et non par une augmentation du débit
cardiaque secondaire à une élévation de la pré-charge ventriculaire. Finalement, les
modifications de posture sont peu efficaces et ne doivent pas être utilisées, d'autant qu'elles
peuvent aggraver l'état respiratoire du patient. De plus, des lésions nerveuses périphériques,
ou un syndrome compartimental au niveau des membres inférieurs compliquent une
compression prolongée ou une traction excessive chez un patient hypotendu, anémique et
placé en position déclive avec surélévation des jambes [31]. Le décubitus latéral gauche
partiel chez la femme enceinte à partir de la 20e semaine d'aménorrhée est finalement la seule
mesure posturale indispensable à pratiquer [32]. Elle est réalisée par une bascule latérale du
bassin (~15°) grâce à la mise en place d'un coussin. Elle prévient l'hypotension artérielle

observée en position couchée, liée à la compression cave inférieure et responsable d'une
souffrance fœtale, d'autant plus sévère qu'il existe une compression aortique simultanée. Bien
que le décubitus latéral gauche soit plus efficace que la mobilisation externe de l'unité utéro-
placento-fœtale pour prévenir ce syndrome aorto-cave, il n'est pas toujours compatible avec
l'acte chirurgical.
Bilan préopératoire
Le bilan préopératoire du patient en état de choc hémorragique est souvent réduit lorsqu'il
s'agit d'une admission directe. Certains renseignements méritent d'être obtenus en se
souvenant de l'acrostiche « AMPHI », adapté des ATLS Guidelines : allergies, médicaments
habituels, passé médical, horaire du dernier repas, itinéraire du patient depuis le début de
l'hémorragie. L'examen clinique évalue la difficulté de l'intubation trachéale et la possibilité
de complications, en particulier secondaires à une lésion du rachis cervical chez un patient
traumatisé [33]. Le bilan biologique comprend des examens pertinents pour la prise en charge
immédiate, selon la pathologie en cause et/ou utiles comme référence pour le suivi biologique
postopératoire (groupe sanguin, numération globulaire, étude biologique de l'hémostase,
ionogramme sanguin, créatininémie, enzymologie hépatopancréatique et musculaire,
gazométrie, recherche de toxiques, diagnostic biologique de grossesse). Les conditions de
distribution des produits sanguins doivent être clairement définies dans chaque établissement.
Pour économiser les concentrés érythrocytaires O Rh négatif, la première détermination du
groupe sanguin est faite sur des prélèvements pratiqués par l'équipe préhospitalière, sur du
sang épanché ou par une technique de prélèvement microcapillaire.
Anesthésie
Patient non intubé
Le choix des médicaments de l'induction est sujet à controverses, car aucune substance ne
provoque une perte de conscience en préservant spontanément une perfusion adéquate chez
un patient en état de choc hémorragique. En général, les posologies doivent être diminuées en
raison de concentrations plasmatiques élevées (réduction du volume de distribution, dilution
des protéines plasmatiques) et de besoins réduits (redistribution préférentielle du flux sanguin
vers le cerveau, hypoxie et hypothermie encéphaliques) [34].
Malgré le risque cardiovasculaire, il est le plus souvent légitime d'administrer un hypnotique
au patient avant l'intubation trachéale pour éviter une éventuelle élévation de pression
intracrânienne et prévenir de possibles réminiscences, malgré une apparente altération de la
conscience. Le thiopental reste la molécule de référence ; sa mauvaise réputation historique
est liée à des posologies inadéquates chez des blessés non réanimés. L'hypotension artérielle
secondaire à son injection est due à une vasodilatation artérielle et veineuse [35] et à un effet
inotrope négatif, à interpréter en fonction d'une puissante réduction du tonus
sympathique [36]. Le thiopental est utile chez les traumatisés encéphaliques par son effet
anticonvulsivant et le fait qu'il réduit la pression intracrânienne (PIC) et la consommation
d'oxygène cérébrale (CMRO2) [22]. Une posologie moyenne de 2,5 mg · kg-1 est
recommandée. La kétamine est volontiers présentée comme l'hypnotique idéal pour le patient
en état de choc hypovolémique [37]. Elle a toutefois un effet cardiodépresseur direct [38] et la
libération de catécholamines et d'angiotensine qu'elle provoque s'accompagne d'une
hypotension, d'une bradycardie et d'une réduction du volume d'éjection systolique chez
l'animal hypovolémique [39] [40]. Dans cette circonstance, elle provoque une acidose
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%