Cours - PhyZik

A4
Sources de lumière
Comment modifier les caractéristiques de la lumière émise par une source ?
La matière joue-t-elle un rôle dans l’émission de la lumière ?
I - Les sources de lumière
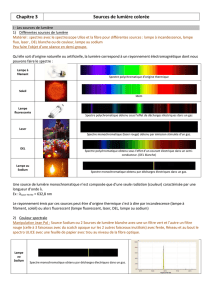
1) Différentes sources de lumière
Matériel : spectres avec le spectroscope Ulice et la fibre pour différentes sources : lampe à incandescence, lampe
fluo, laser , DEL blanche ou de couleur, lampe au sodium
Peu faire l’objet d’une séance en demi-groupe.
Qu’elle soit d’origine naturelle ou artificielle, la lumière correspond à un rayonnement électromagnétique dont nous
pouvons faire le spectre :
Lampe à
filament
Spectre polychromatique d’origine thermique
Soleil
Idem
Lampe
fluorescente
Spectre polychromatique obtenu sous l’effet de décharges électriques dans un gaz
Laser
Spectre monochromatique (laser rouge) obtenu par émission stimulée d’un gaz.
DEL
Spectre polychromatique obtenu sous l’effet d’un courant électrique dans un semi-
conducteur. (DEL blanche)
Lampe au
Sodium
Spectre monochromatique obtenu par décharges électriques dans un gaz.
Une source de lumière monochromatique n’est composée que d’une seule radiation (couleur) caractérisée par une
longueur d’onde λ.
Ex : λLaser He-Ne = 632,8 nm
Le rayonnement émis par ces sources peut être d’origine thermique c’est à dire par incandescence (lampe à
filament, soleil) ou alors fluorescent (lampe fluorescent, laser, DEL, lampe au sodium)
2) Couleur spectrale
Manipulation Jean Pol : Source Sodium ou 2 Sources de lumière blanche avec une un filtre vert et l’autre un filtre
rouge (celle à 3 faisceaux avec du scotch opaque sur les 2 autres faisceaux inutilisés) avec fente, Réseau et au bout le
spectro ULICE avec une feuille de papier avec trou au niveau de la fibre optique.
Lampe
au
Sodium
Spectre monochromatique obtenu par décharges électriques dans un gaz.

Lumières
vertes et
rouges
spectre polychromatique correspondant à la synthèse additive des deux
lumières.
Les deux lumières sont perçues jaunes sur un écran. Elles produisent la même sensation de couleur mais leurs
spectres sont bien différents.
Il faut donc faire la différence entre la couleur perçue et la couleur spectrale.
II - Les rayonnements sont-ils tous visibles ?
Les ondes électromagnétiques dites « visibles »
sont perçues par le système visuel humain.
Le domaine visible correspond à des radiations
de longueurs d’ondes λ comprises entre 380 nm
et 780 nm. Il est limité par les ultra-violets ( λ <
380nm ) et les infrarouges ( λ > 780 nm ).
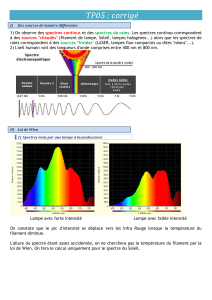
III – La lumière émise par une source chaude dépend-elle de sa température ?
Expérience : lampe à filament montée sur un alternostat + spectroscope à fibre optique
La lampe à filament peut être assimilée à un « corps noir » c'est-à-dire qu’elle absorbe toutes les radiations qu’elle
reçoit et émet des radiations avec toutes les longueurs d’onde quand elle est chauffée.
Toutes ces radiations ne sont pas émises avec la même intensité.
A basse température, le filament de l’ampoule apparait rouge. Il semble ensuite jaune quand la température
augmente puis blanc à haute température.
La longueur d’onde λmax de la radiation émise avec le maximum d’intensité dépend de la température de la source.
Elle suit la loi de Wien :
λmax.T = constante = 2,898.10-3 m.K
Rq : Température en Kelvin
Activité – température de surface du Soleil
0
273
295
K Kelvin, échelle absolue
de température
°C degrés Celsius
-273
0
22

IV – Interaction lumière-matière
Intro : Photo de Solvay avec les noms et les prix Nobel
1) Effet photoélectrique
Expérience en « live » : une baguette en verre est frottée avec une peau de chat pour charger positivement la
baguette. On l'approche du plateau de l'électroscope sans qu'elle ne le touche (l'électroscope se charge par
influence).
On pose le doigt sur le plateau pour le mettre à la terre. On retire le doigt puis on éloigne la baguette du plateau :
L'électroscope est alors chargé négativement. Les photons de la lampe UV vont pouvoir extraire les électrons de la
plaque de zinc à condition de retirer la vitre en verre (qui absorbe les photons dans les UV).
Un corps métallique est soumis à un rayonnement lumineux (UV). Sous l’effet de ce rayonnement, des électrons sont
émis par ce métal.
Si le métal est relié à un électroscope, nous pouvons remarquer qu’une partie des charges négatives c'est-à-dire des
électrons a disparu.
On montre que :
L’énergie E des électrons extraits du métal dépend de la fréquence ν de la lumière d’éclairage mais pas de son
intensité. L’intensité n’influence que sur la quantité d’électrons éjectés.
La lumière doit être reçue à une fréquence ν donnée par le type de métal pour donner naissance à l’effet
photoélectrique.
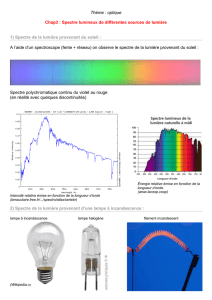
2) Spectres d’émission et d’absorption d’une substance
Expérience : montrer spectre d’émission du Na avec la fibre optique et celui d’absorption avec tout le gros montage.
Si pas possible, utiliser l’animation spectre abs et em
L’émission et l’absorption de la lumière par les substances ne se produit pas de façon continue mais par portions
finies ou par quantas.
3) Synthèse
Pour la matière : - Un atome ne peut exister que dans des états bien définis, chaque état étant caractérisé par un
niveau d’énergie E. L’énergie d’un atome est quantifiée.
Pour la lumière : - Une radiation lumineuse transporte un quantum d’énergie :
avec constante de Planck
en Joules : J
en Hertz : Hz
- Un rayonnement monochromatique peut être assimilé à une particule appelée photon.
Rq :
donc
avec vitesse de la lumière
Application :
L’énergie nécessaire pour extraire un électron de la plaque de zinc est .
Quelle sont la fréquence et la longueur d’onde du rayonnement correspondant ?
C’est la fréquence de seuil pour laquelle l’effet photoélectrique peut avoir lieu.
(domaine des UV). Longueur d’onde de seuil.

Photon
absorbé
Esup
Einf
e–
.
E
Photon émis
V – Diagrammes de niveau d’énergie
1) Cas de l’émission de lumière
Un atome excité retourne spontanément à un niveau d’énergie plus
faible en émettant un photon d’énergie :
Expérience : montrer un spectre d’émission de raies colorées
2) Cas de l’absorption de lumière
Un atome peut absorber un photon d’énergie :
pour passer à un niveau d’énergie
supérieur.
Expérience : montrer un spectre d’absorption de raies noires
DI – Feu d’artifice
Activité – Spectre solaire
E
Esup
Einf
e–
.
1
/
4
100%