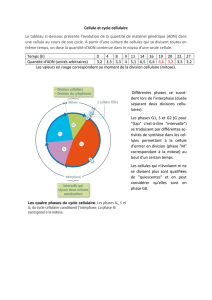
Modifications morphologiques observables par microscopie

Exemple d’exploration cellulaire : le cas de
l'apoptose
Modifications morphologiques observables par microscopie photonique conventionnelle
Modifications morphologiques observables par microscopie électronique : modifications
de la membrane plasmique, du noyau (condensation et fragmentation) associées à une
rétraction du cytoplasme à l’origine de la diminution de la taille cellulaire (cellules
normales en A-D et apoptotiques en B-E-G). La photo C montre des corps apoptotiques
en cours de phagocytose par un macrophage. Les photos H illustrent le processus de
nécrose se caractérisant principalement par des altérations cytoplasmiques.
H
G
- condensation du noyau
- fragmentation du noyau
- aspect bourgeonnant de
la membrane plasmique

Microscopie à fluorescence : marquage de l’ADN avec de l’Hoescht sur des cellules normales
en A et à différents stades d’un processus apoptotique (photos B à D).
Observations en microscopie à fluorescence des modifications du cytosquelette au niveau de
certains types de filaments.
Filaments de cytokératine
En A) cellules normales
En B) cellules apoptotiques
Filaments de vimentine
En A) cellules normales
En B) cellules apoptotiques

Exemple de marquage immunohistochimique obtenu sur une coupe de tissu avec un Ac anti-
caspase-3 activée lors d’un processus apoptotique (photo A) par rapport à des cellules
témoins normales (photo B). Dans le cas présent il s’agit d’une réaction immunoenzymatique
réalisée avec un substrat chromogène marron.
Principe de fonctionnement d’un cytomètre. La CMF est une technique d’analyse de cellules ou
particules en suspension dans une gaine liquide permettant de les faire passer une à une à grande
vitesse (plusieurs milliers d’évènements par seconde) devant un ou plusieurs faisceaux lasers. Un
système optique et informatique sophistiqué permettra l’analyse des propriétés optiques des cellules
(diffraction et réflexion lumineuse), ainsi que l’analyse de la fluorescence émise par la fixation de
sondes spécifiques (fluorochromes, sondes fluorescentes, anticorps marqués…).
A
B

Les signaux détectés par le système optique sont amplifiés, convertis en signaux
électroniques puis en valeurs numériques qui seront analysées grâce à l'unité informatique du
cytomètre. L'affichage simultané des paramètres, FSC, SSC traités par le logiciel, visualise
chaque cellule sur écran sous forme de point. C'est le cytogramme, nuage de signaux
punctiformes qui apparaît (cytogramme A pour des cellules normales et cytogrammes B avec des
cellules en apoptose).
A
B
Exemple d’immunomarquage réalisé en CMF avec un
anticorps reconnaissant la caspase-3 activée.
Analyse des modifications nucléaires par cytométrie : étude de l’ADN-ploïdie encore appelée pic sub-
G0/G1 apparaissant dans les cellules ayant une faible capacité de marquage de l’ADN, par exemple lors de
l’apoptose. Cette approche est depuis considérée comme un marqueur de mort cellulaire par apoptose.

Etude de la fragmentation internucléosomale de l’ADN.
* photo A : dans cette expérience, de l’ADN a été extrait à partir de cellules cultivées dans 3
conditions différentes (conditions normales, apoptotiques ou nécrotiques). Cet ADN a été ensuite
coloré puis soumis à migration sur un gel d’électrophorèse, dans lequel plus les fragments d’ADN sont
petits et plus ils migrent rapidement. Dans les conditions normales de culture, l’ADN est entier c’est à
dire non fragmenté, tandis que pour des cellules apoptotiques on obtient un profil dit « en barreaux
d’échelle » correspondant à la migration de fragments qui sont des multiples de 180-200 paires de
bases. Enfin dans le cas d’une mort cellulaire par nécrose, les DNAses mises en jeu fragmentent l’
ADN au hasard ce qui donne toute une série de fragments de taille irrégulière conduisant à cet aspect
étalé et régulier du gel.
* photo B : illustration du processus de fragmentation internucléosomale de l’ADN au cours de
l’apoptose responsable de la génération de fragments d’ADN de 180-200 paires de base.
+ TdT
Fragmentation de
l’ADN
Addition de dUTP biotinylés aux
extrémités 3’OH libres de l’ADN
Addition de
streptavidine- FITC
Principe de la technique TUNEL (pour Tdt-mediated dUTP-biotin Nick End Labeling) : l'utilisation de la
Terminal déoxynucléotidyltransférase (Tdt) permet d'ajouter des désoxyribonucléotides (dUTP) aux extrémités 3'
OH terminales libres de l'ADN. Un système de révélation est associé à ces nucléotides (par exemple dUTP
biotinylés révélés par de la streptavidine-FITC) permettant de localiser les fragments d'ADN.
 6
6
 7
7
1
/
7
100%