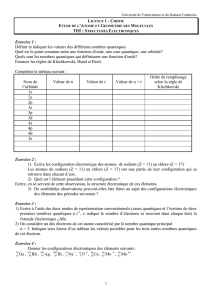
Classification périodique des éléments

Chimie
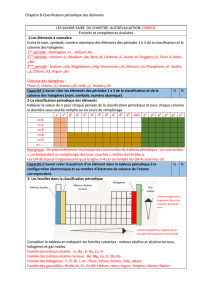
Classification périodique des éléments
1-Principe de construction du tableau périodique
Mendeleïev (1869) a construit la classification périodique en fonction de la masse (A).
Aujourd’hui, elle est en fonction du numéro atomique (Z).
(Voir suite feuille)
2-Structure du tableau
(Voir feuille)
3-Familles d’éléments
Dans la une colonne, les éléments ont le même nombre d’électrons dans la couches externe.
4-Anomalies de remplissage
Il existe un certain nombre d’anomalies de remplissage des sous couches d et f par rapport à la
règle de Klechkouski.
Ex :
•Pour Cr (Z=24), on attend la configuration électronique :
4s2 3d4
[Ar] 3d4 4s2 ↑↓ ↑ ↑ ↑ ↑
Enfait, on a :
4s1 3d5
[Ar] 3d5 4s1 ↑ ↑ ↑ ↑ ↑ ↑
•Pour Cu (Z=29), on attend la configuration électronique :
4s2 3d9
[Ar] 3d9 4s2 ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑
Enfait, on a :
4s1 3d10
[Ar] 3d10 4s1 ↑ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓

On montre expérimentalement que la configuration
soit de sous couche à demi pleine (ex : 3d5)
soit de sous couche pleine (ex : 3d10)
présente une énergie inférieur à ce que prévoit la théorie.
Les anomalies pouvant s’expliquer présentent ce type de sous couche pleine ou demi pleine.
Les autres sont plus difficiles à interpréter.
5-Prédictions des degrés d’oxydation
exemples :
• F (halogène) configuration en [He] 2s2 2p5
→ anion monochargé F
[He] 2s2 2p6 = isoélectronique de Ne
→ degré d’oxydation favorable -I
• Na (alcalin) configuration en [Ne] 3s1
→ cation monochargé Na+ [Ne] 3s0 =isoélectronique de Ne
→ degré d’oxydation favorable +I
• Fe configuration en [Ar] 3d6 4s2
→ Fe2+ [Ar] 3d6 4s0
degré d’oxydation +II = sous couche 4s vide
→ Fe3+ [Ar] 3d5 4s0
degré d’oxydation +III = sous couche 4d demi remplie
• Mn configuration en [Ar] 3d5 4s2
degrés d’oxydation observés : 7, 6, 4, 3, 2
→Mn2+ [Ar] 3d5 4s0
degrés d’oxydation +II = sous couche 3d semi remplie
→Mn7+ [Ar] 3d0 4s0
degrés d’oxydation +VII = sous couche 3d et 4s vide
→ Pas d’explication simple pour des autres degrés d’oxydation.
6-Métaux et non-métaux
(Voir feuille)
7-Périodicité des propriétés atomiques
Exceptions à la règle générale : interprétation

Les états :
-en sous couche vide
-en sous couche pleine
-en sous couche demi remplie (maximum de spins parallèles)
sont favorisés.
Ils contribuent à changer l’énergie d’ionisation
-dans le sens d’une augmentation
si l’atome neutre à une configuration électronique favorisée.
-dans le sens d’une diminution
si le cation (après l’arrachement d’un électron) est favorisé.
Exemples :
• Be Be+
1s2 2s2 > 1s2 2s2
↑↓ ↑↓ ↑↓ ↑
favorable > énergie d’ionisation plus élevé (9,3 eV)
• B B+
1s2 2s2 2p1 > 1s2 2s2 2p0
↑↓ ↑↓ ↑ ↑↓ ↑↓
favorable > énergie
d’ionisation
plus faible
(8,3 eV)
• N N+
1s2 2s2 2p3 > 1s2 2s2 2p2
↑↓ ↑↓ ↑ ↑ ↑ ↑↓ ↑↓ ↑ ↑
favorable > énergie d’ionisation plus élevé (14,5 eV)
• O O+
1s2 2s2 2p4 > 1s2 2s2 2p3
↑↓ ↑↓ ↑↓ ↑ ↑ ↑↓ ↑↓ ↑ ↑ ↑
favorable > énergie
d’ionisation
plus faible
(13,6 eV)
Aux exception près :

Exceptions à la règle générale : interprétation
=effet des couches remplies ou demi remplies
• Be Be-
1s2 2s2 2p0 > 1s2 2s2 2p1
↑↓ ↑↓ ↑↓ ↑↓ ↑
favorable > affinité électronique plus faible (0 eV)
• C C-
1s2 2s2 2p2 > 1s2 2s2 2p3
↑↓ ↑↓ ↑ ↑ ↑↓ ↑↓ ↑ ↑ ↑
favorable > affinité
électronique
plus élevée
(1,26 eV)
Electronégativité

Rayon atomique : distance moyenne des électrons les plus externes au noyau.
Rayon de convalence : moitié de la distance entre les noyaux au sein d’une molécule.
Rayon de van der Waals : moitié de la plus petite distance entre deux noyaux de molécules
différentes.
rayons convalents (en nm)
8-Conclusion
 6
6
1
/
6
100%