chapitre 1 : rappels

1
CHIMIE ORGANIQUE I
CHAPITRE 1 : RAPPELS
L’ATOME
1.1 : Composition
- Essentiel de la masse concentrée dans le noyau (protons + neutrons).
- Noyau chargé +; charge unitaire : proton.
- Électrons autour du noyau, chargés négativement.
- Les électrons sont les seules particules mises en jeu dans les réactions chimiques.
1.2 : Représentation électronique
- La position des électrons autour du noyau est définie par une région de forte
probabilité de présence, appelée orbitale atomique.
- Les orbitales (s, p, d, f, …) sont situées à divers niveaux principaux d’énergie (1, 2, 3,
…)
- On peut écrire la configuration électronique des éléments :
C : 1s2 2s2 2p2
ou
C : 1s2 2s2 2px 2py
- Les orbitales « s » sont de forme sphérique;
- Les orbitales « p » se présentent sous la forme de ballons allongés orientés
perpendiculairement selon les axes x, y et z .
Voir figure 1.1 page 4.
- Électrons du dernier niveau énergétique appelés électrons périphériques;
- Les autres sont des électrons internes.
- Dans les électrons périphériques, distinguons les électrons célibataires (seuls dans une
orbitale) et les électrons appariés (2 dans une orbitale).
- Les orbitales à demi-remplies ont tendance à gagner ou perdre un électron, pour que le
dernier niveau énergétique de l’atome soit complet (règle de l’octet).

2
Représentation de Lewis
- Seuls les électrons périphériques sont représentés :
1.3 : Propriétés
Énergie d’ionisation
- L’énergie requise pour arracher un électron (périphérique) d’un atome est appelée
énergie d’ionisation.
- Celle-ci varie selon :
o La charge nucléaire;
o Le niveau d’énergie de l’orbitale considérée;
o L’effet d’écran;
o La répulsion électronique.
Voir tableau 1.1 page 5.
- La connaissance de l’énergie d’ionisation permet de comprendre la formation d’ions.
- En chimie organique, le proton (H+) et les carbones chargés positivement, appelés ions
carboniums, sont rencontrés fréquemment.
Taille des atomes
- La taille des atomes varie selon la position dans le tableau périodique.
- La dimension est reliée au nombre d’électron de l’atome, et à sa charge nucléaire.
Voir tableau 1.2 page 6.
Électronégativité
- L’électronégativité est la tendance relative d’un élément à attirer vers lui le doublet
d’électrons de la liaison.
- On considère généralement l’électronégativité selon Pauling.
- Propriété qui permet de prévoir le sens du déplacement des doublets d’électrons lors
de transformations chimiques.
Voir tableau 1.3 page 7.

3
LA MOLÉCULE
1.4 : Propriétés
- Les propriétés des molécules dépendent du type de liaisons intramoléculaires et
intermoléculaires qui les caractérisent.
Exemple : solubilité de différents produits dans l’eau
- L’eau dissout facilement les substances ioniques, à cause de sa grande efficacité à
solvater les ions positifs et négatifs.
- L’eau dissout également les substances covalentes polaires; ici, ce sont plutôt les
interactions dipôle-dipôle qui prédominent et favorisent la dissolution.
- L’eau ne dissout pas les substances covalentes non polaires car il est pratiquement
impossible pour l’eau d’entrer en interaction avec elles.
Voir tableau 1.4 page 8.
1.5 : Liaisons intramoléculaires
- L’électronégativité (en fait, la différence d’électronégativité entre les 2 atomes qui
constituent la liaison) joue ici un rôle capital.
- Deux atomes de même électronégativité partagent un doublet électronique de manière
égale.
- On a donc une liaison covalente non polaire.
- Si les 2 atomes n’ont pas la même électronégativité, il peut se produire 2 choses :
1) La différence d’électronégativité est grande (1,7 et plus);
- Il se produit un transfert d’électrons d’un atome à un autre.
- Il en résulte la production d’ions, qui s’unissent par attractions électrostatiques.
2) La différence d’électronégativité est faible (moins de 1,7);
- Il y a un partage inégal des électrons entre les 2 atomes;
- Toutefois, il n’y a pas production d’ions.
- On obtient alors une liaison covalente polaire.
Voir le tableau 1.5 page 9 (IMPORTANT).
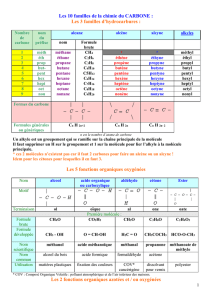
1.5.1 : Liaison covalente : cas du carbone
- L’atome de carbone a la capacité de se lier à lui-même soit par liaison simple, soit par
liaisons multiples (voir tableau 1.6 page 10).
- Le nombre de liaisons entre les atomes de carbone définit la géométrie des molécules.
- Comment une liaison entre deux atomes de carbone peut-elle conduire à une molécule
plane, linéaire ou tridimentionnelle?
o Hybridation des orbitales atomiques.

4
HYBRIDATION DU CARBONE
- Il y a 3 possibilités d’hybridation pour le carbone : sp3, sp2 et sp.
IMPORTANT : tableau 1.7 page 12.
Hybridation sp3 :
- géométrie tétraédrique
- 4 voisins
- angles de liaison : 109°28’
- 4 liaisons
- Rotation continuelle autour de l’axe de liaison
- Exemple : méthane
Hybridation sp2 :
- géométrie plane
- 3 voisins
- angles de liaison : 120°
- 3 liaisons
- 1 liaison
- Isomérie cis-trans
- Exemple : éthylène
Hybridation sp :
- géométrie linéaire
- 2 voisins
- angles de liaison : 180°
- 2 liaisons
- 2 liaisons
- Importante densité électronique entre atomes liés par lien triple
- Exemple : acétylène
Présence de plusieurs types d’hybridation
- chaque hybridation conserve ses propriétés;
- la géométrie d’une telle molécule est plus complexe.
Voir exemple page 15, repris en classe.

5
Théorie de la répulsion électronique
- Hypothèse : autour d’un noyau central, les nuages électroniques qui l’entourent se
disposent dans l’espace de façon symétrique la moins encombrante possible.
- Nuages électroniques pertinents : ceux des liaisons , et ceux des doublets libres de
l’élément central.
- Ces nuages sont appelés voisins.
- Le nombre de voisins détermine la géométrie autour de l’atome central et par le fait
même, le type d’hybridation.
o 4 voisins : géométrie tétraédrique, sp3
o 3 voisins : géométrie plane, sp2
o 2 voisins : géométrie linéaire, sp.
1.5.2 : Polarité des molécules
- Le carbone et l’hydrogène (principaux constituants des composés organiques) forment
des liaisons covalentes polaires avec des éléments tels l’oxygène, l’azote et les
halogènes.
- Il y a donc une déformation du nuage électronique causée par la différence
d’électronégativité entre les atomes liés.
- Il y a donc création d’un dipôle (voir page 17 pour la représentation graphique).
Comment détermine-t-on si une molécule est polaire ou non?
- Il faut tenir compte de la géométrie de la molécule, et de l’électronégativité des
atomes présents.
Ex : CH3Cl vs CH4.
Voir également tableau 1.8 page 19 pour longueur et énergie de liaison.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
1
/
98
100%