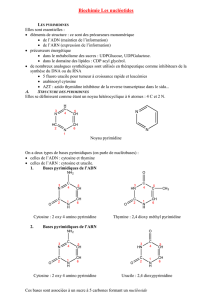
I. Les pyrimidines

I. LES PYRIMIDINES
Elles sont essentielles :
éléments de structure : ce sont des précurseurs monomérique
de l’ADN (maintien de l’information)
de l’ARN (expression de l’information)
précurseurs énergétique
dans le métabolisme des sucres : UDPGlucose, UDPGalactose.
dans le domaine des lipides : CDP acyl glycérol.
de nombreux analogues synthétiques sont utilisés en thérapeutique comme inhibiteurs de la
synthèse du DNA ou du RNA
5 fluoro uracile pour tumeur à croissance rapide et leucémies
arabinosyl cytosine
AZT : azido thymidine inhibiteur de la reverse transcriptase dans le sida...
A. STRUCTURE DES PYRIMIDINES
Elles se définissent comme étant un noyau hétérocyclique à 6 atomes : 4 C et 2 N.
N
HC NCH
CH
H
C
1
2
345
6
N
N
Noyau pyrimidine
On a deux types de bases pyrimidiques (on parle de nucléobases) :
celles de l’ADN : cytosine et thymine
celles de l’ARN : cytosine et uracile.
1. Bases pyrimidiques de l’ADN
N
CN
H
CH
CH
C
O
NH2
1
2
345
6
HN
CN
H
CH
C
C
O
O
CH3
1
2
34
6
5
Cytosine : 2 oxy 4 amino pyrimidine
Thymine : 2,4 dioxy méthyl pyrimidine

PC1 Biochimie G page 2
2. Bases pyrimidiques de l’ARN
N
CN
H
CH
CH
C
O
NH2
1
2
345
6
HN
CN
H
CH
CH
C
1
2
345
6
O
O
Cytosine : 2 oxy 4 amino pyrimidine
Uracile : 2,4 dioxypyrimidine
Ces bases sont associées à un sucre à 5 carbones formant un nucléoside
O
OH
H H
OH
H
OH
CH2OH
H
1
2
5
O
OH
H H
H
H
OH
CH2OH
H
1
2
le ribose dans l’ARN
le déoxyribose dans l’ADN
L’association base + sucre + ester phosphate (sur C5 du ribose) donne un nucléotide.
nucléobase
nucléoside
nucléotide
ARN
cytosine
cytidine
cytidilate
CMP
uracile
uridine
uridylate
UMP
ADN
cytosine
déoxycytidine
déoxycytidilate
dCMP
thymine
déoxythymine
deoxythymidilate
dTMP
B. BIOSYNTHESE DE LA PYRIMIDINE
Plusieurs étapes qui présentent par rapport au métabolisme des purines des différences et des
similitudes
la synthèse commence par la pyrimidine puis il y a addition du sucre phosphate.

PC1 Biochimie G page 3
L’essentiel des réactions de cette biosynthèse (7 étapes) est coordonné au sein de complexes
enzymatiques multifonctionnels. Les trois premières et les deux dernières sont associées en
complexes multi-enzymatique. Les enzymes sont liées sur les mêmes chaînes polynucléotidiques ce
qui assure une meilleure efficacité.
Les précurseurs de la biosynthèse sont la glutamine, le CO2 et l’acide aspartique.
N
HC NCH
CH
H
C
1
2
345
6
acide aspartique
CO2
Glutamine
L’acide aspartique donnera naissance à C4,
C5, C6 et N1.
C2 vient du CO2.
N3 vient de la gluatmine.
1. Première étape : formation du carbamyl phosphate
C’est l’association de CO2 et d’azote de la glutamine pour donner le carbamyl phosphate.
Dans l’uréogenèse, cette réaction se déroule dans les mitochondries hépatiques et le donneur d’azote
est NH4+. Dans la synthèse des pyrimidines, elle s’effectue dans le cytosol et l’azote vient de la
glutamine.
Il n’y a pas de cofacteur. L’enzyme est la carbamyl phosphate synthétase.
COOH
CH NH2
(CH2)2
C
O
NH2
COOH
CH NH2
(CH2)2
C
O
OH
NH2
C
O O P
O
O-
O-
Carbamyl Phosphate
Synthétase
a. Glutamique
CO2
Glutamine Carbamyl Phosphate
Pi
2 ATP 2 ADP
2. Deuxième étape : formation du N carbamyl aspartate
Elle se fait par condensation du carbamyl phosphate et de l’aspartate. Cette réaction est catalysée par
l’aspartate transcarbamylase (ATC). Elle est couplée à la première enzyme.
NH2
C
O O P+H2NCH
COO-
CH2
COO-
N
HCH
COO-
CH2
COO-
C
O
H2N
Carbamyl Phosphate Aspartate Carbamyl aspartate
Aspartate
transcarbamylase

PC1 Biochimie G page 4
L’ACTase subit une régulation allostérique comprenant deux effecteurs, l’un purique et l’autre
pyrimidique :
Vitesse de la réaction
[aspartate]
CTP est inhibiteur allostérique (produit de fin de chaîne) :
courbe 3.
ATP est activateur allostérique : courbe 2.
On a mis en évidence deux sous-unités :
une de type catalytique
une de type régulatrice : capable de se lier à l’ATP ou à la
CTP. La CTP est inhibibiteur. L’ATP est capable de
déplacer la CTP, de lever l’inhibition. Pour une même
concentration d’aspartate, les vitesses diffèrent selon qu’on
est en présence d’ATP ou de CTP.
Cela permet un équilibre entre biosynthèse des pyrimidines et des
purines.
3. Troisième étape : formation du dihydro orotate
Une dihydroorotase catalyse la cyclisation. Elle fait partie du même complexe enzymatique
multifonctionnel appelé le CAD : Carbamyl phosphate synthétase - Aspartate transcarbamylase -
Dihydro orotase.
N
HCH
COO-
CH2
COO-
C
O
H2N
Carbamyl aspartate
H2O
HN
CN
H
CH
CH2
C
O
O
COO-
Dihydro orotate
dihydro orotase
4. Quatrième étape : formation de l’orotate
C’est une déshydrogénation. L’enzyme qui intervient est une déshydrogénase qui utilise le NAD
comme coenzyme. L’enzyme est indépendante, non liée à un complexe. Il apparaît une double liaison
entre C5 et C6.
HN
CN
H
CH
CH2
C
O
O
COO-
Dihydro orotate
NAD+NADH + H+
dihydro orotate
déshydrogénase
HN
CN
H
C
CH
C
O
O
COO-
Orotate
1
2
3

PC1 Biochimie G page 5
5. Cinquième étape : formation de l’OMP.
O
OH OH
P-O-CH2
O-P-O-P
HN
CN
H
C
CH
C
O
O
COO-
HN
CNC
CH
C
O
O
COO-
O
OH OH
P-O-CH2
OH
PRPP
transférase
PP
PRPP
Orotate
Orotidine 5' monophosphate
(OMP)
ou acide orotidylique
Elle fait appel au transfert d’un sucre phosphate activé : le PRPP ou phospho ribosyl pyrophosphate.
L’enzyme est une PRPP transférase. Cette étape est liée à la suivante.
6. Sixième étape : formation de l’uridylate monophosphate
Une orotidylate décarboxylase donne par départ d’un CO2 le premier véritable nucléotide à
pyrimidine : UMP.
HN
CNCH
CH
C
O
O
O
OH OH
P-O-CH2
OH
Uridine 5' monophosphate
(UMP)
ou acide uridylique
+ CO2
Le deuxième complexe multifonctionnel , catalysant les étapes 5 et 6 est appelé UMP synthétase.
Chez les eucaryotes, ce type de complexe multiforme est relativement fréquent. Cette fusion
d’enzymes multifonctionnelles a probablement évolué grâce au brassage d’exons. Il permet le
regroupement dans une même finalité de plusieurs chromosomes.
Avantages de ce système :
biosynthèse coordonnée des différentes enzymes nécessaires à une même voie biosynthétique.
assemblage cohérent des différentes enzymes qui donne un complexe fonctionnel
minimise les réactions annexes : si les enzymes sont regroupées, il y a une canalisation des
substrats d’un site actif au suivant.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
1
/
27
100%