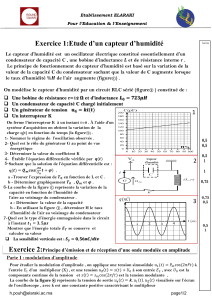
EXERCICE 1 : PILE ET CHARGE D`UN CONDENSATEUR (8 points)

Réunion 2008 http://labolycee.org
EXERCICE 1 : PILE ET CHARGE D’UN CONDENSATEUR (8 points)
Une pile zinc-argent alimente un dipôle série RC. En parallèle avec le condensateur est branché
un système d’utilisation S (voir figure 1 annexe, à remettre avec la copie) dont le fonctionnement
simplifié est le suivant :
- Tant que la tension UC aux bornes du condensateur est inférieure à 1,2 V, le système S est
équivalent à un interrupteur ouvert (de résistance infinie).
- Lorsque UC atteint la valeur uf = 1,2 V, le système S est équivalent à un interrupteur fermé (de
résistance nulle) provoquant la décharge instantanée du condensateur.
- Et le cycle recommence...
L’étude comporte 2 parties indépendantes :
- partie A : étude électrique
- partie B : étude chimique de la pile
PARTIE A : ÉTUDE ÉLECTRIQUE (5 points)
Données :
R = 1,0 M , C = 10 µF.
Dans les conditions de l’expérience, la pile est considérée comme un générateur idéal de
tension, de f.e.m. E = 1,5 V.
La durée de la décharge du condensateur est totalement négligeable devant celle de la charge.
La valeur de la tension de basculement charge / décharge est 1,2 V.
Le sens algébrique du courant électrique est imposé (voir figure 1 annexe). Les tensions aux bornes
de la résistance et du condensateur, notées respectivement uR et uC, respecteront la convention
récepteur.
1. Tracer sur la figure 1 de l’annexe les flèches-tension correspondant à uR et à uC .
2. Établir l’équation différentielle vérifiée par uC lors de la charge du condensateur entre t = 0 et t = tf
(date à laquelle uC = 1,2 V).
3. Quelle serait la valeur maximale prise par la tension uC en l’absence du système S ?
4. La solution de cette équation est : uc(t) = E(1 –
t
e
).
4.1. Préciser l’expression de et donner son nom.
4.2. Montrer que l’expression de est homogène à un temps.
4.3. Calculer la valeur de .
4.4. Déterminer graphiquement la valeur de à l’aide de la figure 2 annexe. Celle-ci devra être
complétée par les constructions nécessaires à cette détermination.
5. Durée de la charge.
5.1. À partir de la solution de uC donnée à la question 4, établir l’expression littérale de t en
fonction de E, uC et .
5.2. Calculer la valeur de
tf
et vérifier l’accord avec la
figure 2 annexe
.
5.3. En déduire la fréquence du phénomène périodique.

6. Intensité dans le circuit de charge.
6.1. Établir l’expression littérale de
i
, à partir de l’expression de
U
C
donnée en question
4
.
6.2. Calculer les valeurs de
i
aux dates
t = 0
et
t = tf
.
7. Aspects énergétiques.
On désigne par
Eélec
l’énergie électrostatique emmagasinée dans le condensateur à une date
t
quelconque.
7.1. Rappeler l’expression de l’énergie
Eélec
en fonction de
C
et de
uC
. Préciser les unités des
grandeurs utilisées.
7.2. Déterminer la valeur de cette énergie à la date
tf
.
7.3. Sur la durée d’un cycle, l’énergie électrique totale délivrée par la pile vaut
EG
= 18 µJ
. Comment
expliquer la différence entre les valeurs
EG
et
Eélec
?
PARTIE B : ÉTUDE CHIMIQUE DE LA PILE (3 points)
La pile zinc-argent est constituée de deux demi-piles reliées par un pont salin et mettant en jeu
les couples oxydant-réducteur Zn2+ (aq) / Zn (s) et Ag+ (aq) / Ag (s)
Chaque demi-pile contient 100 mL de solution, l’une de nitrate de zinc (Zn2+ + 2 NO3–), l’autre de
nitrate d’argent (Ag+ + NO3–). Les concentrations apportées de chacun de ces électrolytes sont
identiques et valent C0= 0,100 moI.L-1. Chacune des deux électrodes a une masse initiale de
1,0 g.
8. Équations de dissolution. Concentrations initiales.
8.1. Écrire les équations de dissolution dans l’eau des deux solides ioniques ayant permis de
réaliser les deux solutions électrolytiques.
8.2. En déduire les concentrations initiales de tous les ions présents dans chacune de ces
solutions aqueuses.
9. Demi-équations. Équation chimique.
9.1. Écrire la demi-équation associée à chaque couple oxydant-réducteur.
9.2. Parmi les deux réactions pouvant se produire à priori lors du fonctionnement de la pile,
écrire celle pour laquelle le métal argent intervient en tant que réactif.
La constante d’équilibre de cette réaction est K = 10 – 52.
10. Sens d’évolution. Polarités.
10.1. Calculer le quotient de réaction initial Qr,i de la réaction écrite à la question 9.2. ci-
dessus, et prévoir le sens d’évolution spontanée du système chimique constituant la pile.
10.2. Écrire l’équation de la réaction dans le sens où elle évolue spontanément.
10.3. Rappeler les définitions d’un oxydant et d’un réducteur, et les identifier dans la
transformation spontanée observée.
10.4. En déduire, en le justifiant, les polarités des électrodes.
10.5. Comment est assurée l’électroneutralité des solutions lors du fonctionnement de la
pile ?
11. Schéma de la pile.
Faire un schéma complet et clair de cette pile en fonctionnement. Rappeler sur ce schéma
les différentes espèces chimiques concernées, les polarités, le sens du courant, ainsi que le
sens de déplacement de tous les porteurs de charge (hors pont salin).

ANNEXE
(à remettre avec la copie)
Figure 2
R = 1 M
G
i
E = 1,5 V
C = 10 F
S
Figure 1
1
/
3
100%