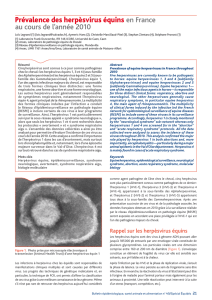
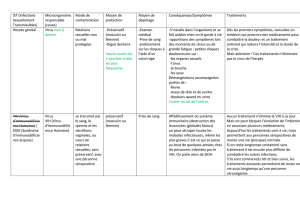
Etude des interactions hôte

[Tapez un texte]
DOSSIER DE PRESSE
PRIX CENTRE D’ETUDES PRINCESSE
JOSÉPHINE-CHARLOTTE 2009
30 NOVEMBRE 2009
CONTACT :
Christel Buelens
christel.buelens@frs-fnrs.be
02/504.92.96
F.R.S. – FNRS

2
Fonds de la Recherche Scientifique-FNRS
REMISE DU « PRIX CENTRE D’ETUDES PRINCESSE JOSÉPHINE-CHARLOTTE 2009 »
LE LUNDI 30 NOVEMBRE 2009 À 11H30
En vue de soutenir la recherche scientifique dans le domaine de la lutte contre les infections
virales, le Centre d’Etudes Princesse Joséphine-Charlotte a chargé le Fonds de la Recherche
Scientifique – FNRS d’attribuer, tous les deux ans, un Prix de 12.500 €.
Ce 30 novembre 2009, le F.R.S. – FNRS procède, en présence de représentants du monde
universitaire et du Centre d’Etudes Princesse Joséphine-Charlotte, à la remise du onzième Prix
biennal.
Le Prix 2009 a été attribué à :
Alain VANDERPLASSCHEN,
Professeur d’Immunologie-Vaccinologie à la Faculté de Médecine vétérinaire de l’Université
de Liège,
Docteur en Médecine vétérinaire,
Docteur en sciences,
Agrégé de l’enseignement supérieur,
pour son travail :
« Etude des interactions hôte-herpèsvirus »
Les herpèsvirus forment une famille virale qui infectent tout le règne animal depuis l’huitre
jusqu’à l’homme. Certains herpèsvirus sont responsables de pathologies graves alors que
d’autres se propagent au sein de leur espèce hôte sans induire la moindre maladie. Les
travaux menés par l’équipe du Prof. Alain Vanderplasschen ont abouti à plusieurs
contributions majeures relatives aux interactions qui surviennent entre les herpèsvirus et leurs
hôtes. Les résultats révèlent des aspects fascinants de l’évolution et de l’adaptation des
herpèsvirus. Parmi les concepts majeurs découverts, citons par exemple: (i) La capacité des
herpèsvirus à neutraliser la réponse immune de l’hôte infecté. Les chercheurs ont pu
déterminer que plusieurs herpèsvirus infectant diverses espèces animales possèdent une
protéine leur permettant d’intercepter les signaux de communication utilisés par les cellules
du système immunitaire. Grâce à cette protéine, le virus parvient à inhiber la coordination de
la réponse immune de l’organisme qu’il infecte. (ii) Les mécanismes d’évolution des
herpèsvirus. En étudiant l’évolution d’un herpèsvirus qui infecte les bovins, les chercheurs ont
pu retracer l’évolution de ce virus au cours du dernier 1,5 millions d’années. Leurs recherches
ont permis d’établir que ce virus évolue depuis au moins 1,5 millions d’années au sein de
l’espèce buffle africain et que sa transmission aux bovins domestiques à partir de ruminants
sauvages est survenue il y a au maximum quelques centaines d’années. De manière plus
générale, les études réalisées ont permis de confirmer plusieurs concepts importants de
l’évolution de la famille des herpèsvirus tels que la vitesse à laquelle ils évoluent, leur
capacité à acquérir des gènes de l’hôte infecté, leur co-évolution avec leur hôte et
l’importance du phénomène de recombinaison dans leur évolution. (iii)

3
L’adaptation spécifique d’un herpèsvirus à son hôte naturel. Un virus parfaitement adapté à
son hôte naturel devrait être capable de se propager au sein de l’espèce hôte sans lui
causer de détriments majeurs. Cette adaptation est la conséquence de la co-évolution
pendant des millions d’années du virus avec son espèce hôte. En étudiant un herpèsvirus du
gnou parfaitement adapté à son hôte naturel, les chercheurs ont pu observer qu’alors que le
virus n’induit aucune maladie chez son hôte naturel, il induit la mort d’autres ruminants en
provoquant une forme de leucémie lymphoïde aiguë. La relation entre le gnou et
l’herpèsvirus qu’il l’infecte peut être qualifiée de symbiotique. En effet, le gnou tire un
bénéfice de l’infection. En transmettant l’herpèsvirus aux espèces de ruminants avec lesquels
il entre en compétition pour ses aires de pâturages, le gnou induit une mortalité chez ces
derniers. Le bénéfice pour le gnou est double. Tout d’abord, il régule de la sorte
négativement la population des ruminants avec lesquels il entre en compétition pour l’herbe.
Ensuite, les animaux succombant à la maladie causée pour le virus représentent des proies
faciles pour les grands carnivores qui se désintéressent des gnous et de leur progéniture.
En plus de leurs implications fondamentales, les recherches menées par le laboratoire du
Prof. A. Vanderplasschen ont également une incidence appliquée. Citons par exemple, le
rôle du laboratoire d’Immunologie-Vaccinologie dans l’amélioration de la technique du BAC
cloning, technique permettant la production de virus génétiquement modifiés, une étape
devenue incontournable pour l’étude des herpèsvirus et la production de vaccin contre
cette famille virale.

4
Monsieur Alain VANDERPLASSCHEN
Professeur d’Immunologie-Vaccinologie
à la Faculté de Médecine vétérinaire de l’Université de Liège
« Etude des interactions hôte-herpèsvirus. »

5
Préambule
La famille des Herpesviridae est sans aucun doute une des familles virales les plus
intéressantes et ce, pour diverses raisons. Premièrement, elle regroupe des espèces virales
infectant tout le règne animal depuis les invertébrés jusqu’aux vertébrés supérieurs dont
l’homme. Ce dernier subit l’infection de plusieurs espèces d’Herpesviridae dont certains sont
responsables de pathologies graves. Deuxièmement, les Herpesviridae sont capables, en plus
d’un cycle réplicatif lytique, d’établir une infection latente réactivable qui persiste durant
toute la vie du sujet infecté. Troisièmement, l’origine de la famille des Herpesviridae est
ancestrale et remonte à au moins 200 millions d’années. Il est généralement admis que les
Herpesviridae ont évolué selon un phénomène de co-spéciation avec leurs hôtes. Ce
processus de co-évolution explique l’adaptation remarquable de certains Herpesviridae à
leur hôte chez qui ils n’induisent aucune pathologie; alors que le passage accidentel de ces
espèces virales chez une espèce hôte non-naturel peut engendrer une pathologie mortelle.
Quatrièmement, les Herpesvirales possèdent un génome de très grande taille (supérieur à
100 kb et pouvant atteindre 300 kb pour l’herpèsvirus cyprin 3 (CyHV-3)) et pourvu de
certains gènes ayant une origine cellulaire. Enfin cinquièmement, l’aspect le plus fascinant
de cette famille virale est, sans aucun doute, la diversité et la complexité des interactions
qu’ils établissent avec leurs hôtes. C’est à ce titre que notre laboratoire étudie divers modèles
d’infection à Herpesviridae. Ci-dessous sont résumés en cinq thématiques les résultats
principaux obtenus par notre laboratoire au cours des 8 dernières années lors de l’étude des
interactions hôtes-herpèsvirus.
I/ Evolution des herpèsvirus
L’herpèsvirus bovin 4 (BoHV-4) est un gammaherpèsvirus appartenant au genre Rhadinovirus
au même titre que l’herpèsvirus humain 8 (HHV-8), l’agent responsable du sarcome de
Kaposi. Le BoHV-4 a été isolé, de par le monde, de bovins sains ou atteints de pathologies
diverses. Son rôle en tant qu’agent étiologique d’une entité précise reste un sujet de
controverses. En 2000, le séquençage du génome du BoHV-4 a révélé un gène nommé Bo17,
présentant un très haut degré d’homologie avec un gène humain codant pour une enzyme
de la famille des -1,6-Nacétylglucosaminyltransférases (1,6GnT) (Vanderplasschen et al.,
2000). Cette découverte est fascinante à plus d’un titre. Tout d’abord, parce que tous les
membres de la famille des 1,6GnTs sont impliqués dans des processus biologiques majeurs,
notamment liés à l’immunité et aux différenciations cellulaires et tissulaires. Ceci laisse
supposer que Bo17 pourrait jouer un rôle clef dans la biologie du BoHV-4. Aucun autre virus
n’étant connu pour exprimer une 1,6GnT, le BoHV-4 représente un modèle unique pour
l’étude de la biologie complexe de cette famille enzymatique dans le contexte d’une
infection virale. Ensuite, le haut degré de conservation de cette séquence virale d’origine
cellulaire a suggéré une acquisition très récente de ce gène par l’ancêtre du BoHV-4 au
cours de l’évolution. L’ORF Bo17 constitue par là un modèle adéquat pour étudier l’origine et
l’évolution d’un gène d’herpèsvirus acquis aux dépends de son hôte.
Nos recherches sur l’ORF Bo17 ont été à l’origine de résultats inespérés. Tout d’abord, nous
avons pu démontrer que la séquence Bo17 du BoHV-4 constitue un gène exprimé au cours
de la multiplication virale et dont le produit d'expression est un homologue fonctionnel de la
C2GnT-M humaine douée des activités core 2, core 4 et I. Le BoHV-4 reste à ce jour le seul
virus qui code pour ce type de glycosyltransferase (Vanderplasschen et al., 2000).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%